题目内容
对氨水溶液中存在的电离平衡NH3?H2O?NH4++OH-,下列叙述中正确的是( )
分析:A.加水稀释能促进氨水电离,NH3?H2O、NH4+、OH-浓度都降低,但氢离子浓度增大;
B.加入相同离子能抑制弱电解质的电离,但该离子浓度增大;
C.升高温度能促进弱电解质的电离,同时增大电离平衡常数;
D.加入少量冰醋酸,溶液由弱电解质变成强电解质溶液,溶液的导电能力与离子浓度成正比.
B.加入相同离子能抑制弱电解质的电离,但该离子浓度增大;
C.升高温度能促进弱电解质的电离,同时增大电离平衡常数;
D.加入少量冰醋酸,溶液由弱电解质变成强电解质溶液,溶液的导电能力与离子浓度成正比.
解答:解:A.加水稀释能促进氨水电离,但氨水电离的量远远小于水增加的量,所以NH3?H2O、NH4+、OH-浓度都降低,C(H+)=
增大,故A错误;
B.加入氯化铵固体,使氨水的电离向逆反应方向移动,但铵根离子增大的量远远大于抑制氨水电离的量,所以溶液中铵根离子浓度增大,故B错误;
C.升高温度促进氨水的电离,NH3?H2O浓度减小,NH4+、OH-浓度增大,所以电离平衡常数增大,故C正确;
D.加入少量冰醋酸,冰醋酸和氨水反应生成盐,溶液由弱电解质标出强电解质溶液,溶液中自由离子浓度增加,导电能力增大,故D错误.
故选C.
| Kw |
| C(OH-) |
B.加入氯化铵固体,使氨水的电离向逆反应方向移动,但铵根离子增大的量远远大于抑制氨水电离的量,所以溶液中铵根离子浓度增大,故B错误;
C.升高温度促进氨水的电离,NH3?H2O浓度减小,NH4+、OH-浓度增大,所以电离平衡常数增大,故C正确;
D.加入少量冰醋酸,冰醋酸和氨水反应生成盐,溶液由弱电解质标出强电解质溶液,溶液中自由离子浓度增加,导电能力增大,故D错误.
故选C.
点评:本题考查电离平衡的移动,明确平衡移动时离子的浓度变化即可解答,注意电离平衡常数只与温度有关,与溶液的浓度无关,难度不大.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
(15分)1、下列有关元素锗及其化合物的叙述中正确的是 ___________
| A.锗的第一电离能高于碳而电负性低于碳 |
| B.四氯化锗与四氯化碳分子都是四面体构型 |
| C.二氧化锗与二氧化碳都是非极性的气体化合物 |
| D.锗和碳都存在具有原子晶体结构的单质 |
(1)铜原子基态电子排布式为 ;
(2)用晶体的x射线衍射法可以测得阿伏加德罗常数。对金属铜的测定得到以下结果:晶胞为面心立方最密堆积,边长为361pm。又知铜的密度为9.00g·cm-3,则阿伏加德罗常数为 (列式计算);
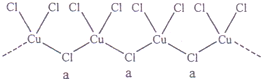
(3)氯和钾与不同价态的铜可生成两种化合物,这两种化合物都可用于催化乙炔聚合,其阴离子均为无限长链结构(如下图),a位置上Cl原子的杂化轨道类型为 。已知其中一种化合物的化学式为KCuCl3,另一种的化学式为 ;
(4)金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是 ,反应的化学方应程式为 。
 (2009?广东)铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂.
(2009?广东)铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂.
 (2009?深圳二模)前四周期元素A、B、C、D、E、F,原子序数依次增大,其中A和B同周期,固态的AB2能升华;C和E原子都有一个未成对电子,C+比E-少一个电子层,E原子的一个电子后3p轨道全充满;D的最高化合价和最低化合价代数和为4,其最高价氧化物中D的质量分数为40%,且核内质子数等于中子数;F为红色单质,广泛用于电气工业.回答下列问题:
(2009?深圳二模)前四周期元素A、B、C、D、E、F,原子序数依次增大,其中A和B同周期,固态的AB2能升华;C和E原子都有一个未成对电子,C+比E-少一个电子层,E原子的一个电子后3p轨道全充满;D的最高化合价和最低化合价代数和为4,其最高价氧化物中D的质量分数为40%,且核内质子数等于中子数;F为红色单质,广泛用于电气工业.回答下列问题: