题目内容
【题目】向炙热的铁屑中通入氯气生产无水氯化铁;向炽热铁屑中通入氯化氢生产无水氯化亚铁。现用如图所示的装置模拟上述过程进行实验。
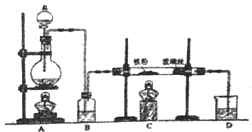
回答下列问题:
(1)制取无水氯化铁的实验中,A中反应的化学方程式为___,B中加入的试剂是___,D中盛放的试剂____。
(2)制取无水氯化亚铁的实验中,装置A用来制取____,尾气的成分是___,仍用D装置进行尾气处理,存在的问题是____、____。
(3)若操作不当,制得的FeCl2会含有少量FeCl3,原因可能是____,欲制得纯净的FeCl2,在实验操作中应先___,再____。
【答案】MnO2 + 4HCl(浓) ![]() MnCl2 + Cl2↑+ 2H2O 浓硫酸 NaOH溶液 HCl HCl和H2 发生倒吸 可燃性气体H2不能被吸收 氯化亚铁被装置内的氧气氧化 通入HCl气体一段时间(排出装置内空气) 点燃C处酒精灯
MnCl2 + Cl2↑+ 2H2O 浓硫酸 NaOH溶液 HCl HCl和H2 发生倒吸 可燃性气体H2不能被吸收 氯化亚铁被装置内的氧气氧化 通入HCl气体一段时间(排出装置内空气) 点燃C处酒精灯
【解析】
由制备氯化铁的实验装置可以知道,A中浓盐酸与二氧化锰反应生成氯气,B中浓硫酸干燥氯气,C中Fe与氯气反应生成氯化铁,D中NaOH溶液吸收尾气;
若制备无水氯化亚铁,A中浓硫酸与NaCl反应生成HCl,B中浓硫酸干燥HCl,C中炽热铁屑中与HCl反应生成无水氯化亚铁,D为尾气处理,但导管在液面下可发生倒吸。
⑴由制备氯化铁的实验装置可以知道,A中浓盐酸与二氧化锰反应生成氯气,反应为
MnO2 + 4HCl(浓) ![]() MnCl2 + Cl2↑+ 2H2O,装置B主要作用是干燥氯气,因此B中加入的试剂是浓硫酸,D装置主要是处理尾气,因此用NaOH溶液来处理尾气;故答案分别为MnO2 + 4HCl(浓)
MnCl2 + Cl2↑+ 2H2O,装置B主要作用是干燥氯气,因此B中加入的试剂是浓硫酸,D装置主要是处理尾气,因此用NaOH溶液来处理尾气;故答案分别为MnO2 + 4HCl(浓) ![]() MnCl2 + Cl2↑+ 2H2O;浓硫酸;NaOH溶液;
MnCl2 + Cl2↑+ 2H2O;浓硫酸;NaOH溶液;
⑵制取无水氯化亚铁的实验中,装置A用来制取HCl,Fe与HCl反应生成氢气,可以知道尾气的成分是HCl和H2,若仍用D的装置进行尾气处理,存在的问题是发生倒吸、可燃性气体H2不能被吸收,故答案分别是HCl;HCl和H2;发生倒吸;可燃性气体H2不能被吸收;
⑶若操作不当,制得的FeCl2会含有少量FeCl3,主要原因是氯化亚铁被装置内的氧气氧化,欲制得纯净的FeCl2,在实验操作中应先通入HCl气体一段时间(排出装置内空气),再点燃C处酒精灯,故答案分别是氯化亚铁被装置内的氧气氧化;通入HCl气体一段时间(排出装置内空气);点燃C处酒精灯。