题目内容
(9分)为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
 (1)判断BaCl2已过量的方法是 。
(1)判断BaCl2已过量的方法是 。
(2)第④步中,写出相应的化学方程式:
; ____________________________.
(3)在 中填写所使用除杂试剂的化学式__________,在()中的操作名称是____ 。
中填写所使用除杂试剂的化学式__________,在()中的操作名称是____ 。
(4)从实验设计方案优化的角度分析步骤②和④可否颠倒____________(填“是”或“否”,如果“否”,请说明理由。)原因是:_______________________ _______ _;
步骤③和④可否颠倒____________。
(5)若先用盐酸再进行操作⑤,将对实验结果产生影响,其原因是: 。
 (1)判断BaCl2已过量的方法是 。
(1)判断BaCl2已过量的方法是 。(2)第④步中,写出相应的化学方程式:
; ____________________________.
(3)在
 中填写所使用除杂试剂的化学式__________,在()中的操作名称是____ 。
中填写所使用除杂试剂的化学式__________,在()中的操作名称是____ 。(4)从实验设计方案优化的角度分析步骤②和④可否颠倒____________(填“是”或“否”,如果“否”,请说明理由。)原因是:_______________________ _______ _;
步骤③和④可否颠倒____________。
(5)若先用盐酸再进行操作⑤,将对实验结果产生影响,其原因是: 。
(9分)(1)取第②步后的上层清液1~2滴于点滴板上(或取少量上层清液于试管中),再滴入1~2滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量(合理答案皆可)
(2)Ca2+ + CO32- = CaCO3↓; Ba2+ + CO32- = BaCO3↓
(3)NaOH 过滤 (4)否;过量的BaCl2必须要用Na2CO3除去,步骤复杂;是;
(5)会有部分沉淀溶解,从而影响制得精盐的纯度
(2)Ca2+ + CO32- = CaCO3↓; Ba2+ + CO32- = BaCO3↓
(3)NaOH 过滤 (4)否;过量的BaCl2必须要用Na2CO3除去,步骤复杂;是;
(5)会有部分沉淀溶解,从而影响制得精盐的纯度
考查物质的分离和提纯。Ca2+用碳酸钠除去,Mg2+用氢氧化钠除去,SO42-用氯化钡除去,最后加入盐酸酸化。但用于过量的氯化钡要用碳酸钠来除,所以碳酸钠必需放在氯化钡的后面,而氢氧化钠可以随意调整。
(1)判断BaCl2已过量的方法是继续加入氯化钡溶液,即取第②步后的上层清液1~2滴于点滴板上(或取少量上层清液于试管中),再滴入1~2滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量。
(2)由于过量的氯化钡也要碳酸钠来除去,反应该步骤的方程式是Ca2+ + CO32- = CaCO3↓、 Ba2+ + CO32- = BaCO3↓。
(3)根据以上的分析可知,该试剂是氢氧化钠,把不溶性固体分离出的方法是过滤。
(4)由于过量的BaCl2必须要用Na2CO3除去,所以步骤②和④不能颠倒。由于过量的氢氧化钠不需要碳酸钠来除去,所以步骤③和④可以颠倒。
(5)如果先用盐酸酸化,则会有部分沉淀溶解,从而影响制得精盐的纯度。
(1)判断BaCl2已过量的方法是继续加入氯化钡溶液,即取第②步后的上层清液1~2滴于点滴板上(或取少量上层清液于试管中),再滴入1~2滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量。
(2)由于过量的氯化钡也要碳酸钠来除去,反应该步骤的方程式是Ca2+ + CO32- = CaCO3↓、 Ba2+ + CO32- = BaCO3↓。
(3)根据以上的分析可知,该试剂是氢氧化钠,把不溶性固体分离出的方法是过滤。
(4)由于过量的BaCl2必须要用Na2CO3除去,所以步骤②和④不能颠倒。由于过量的氢氧化钠不需要碳酸钠来除去,所以步骤③和④可以颠倒。
(5)如果先用盐酸酸化,则会有部分沉淀溶解,从而影响制得精盐的纯度。

练习册系列答案
 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
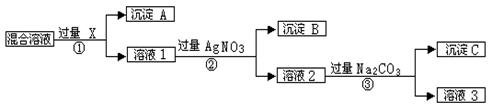 请回答下列问题:
请回答下列问题: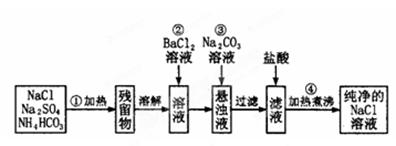
 已除尽,方法是___________________________。
已除尽,方法是___________________________。