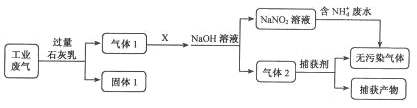
题目内容
【题目】工业上用某矿渣(含有Cu2O、Al2O3,Fe2O3、SiO2)制取铜的操作流程如下:
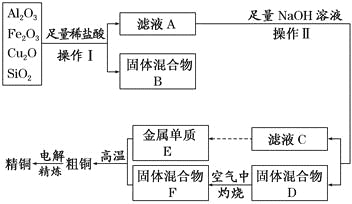
已知:Cu2O+2H+= Cu+Cu2++H2O
(1)实验操作Ⅰ的名称为 ;在空气中灼烧固体混合物D时,用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有 (填仪器名称)。
(2)滤液A中铁元素的存在形式为 (填离子符号),生成该离子的离子方程式为 ,检验滤液A中存在该离子的试剂为 (填试剂名称)。
(3)金属E与固体F发生的某一反应可用于焊接钢轨,该反应的化学方程式为 。
(4)常温下,等pH的NaAlO2和NaOH两份溶液中,由水电离出的c(OH-)前者为后者的108倍,则两种溶液的pH= 。
(5)利用电解法进行粗铜精炼时,下列叙述正确的是 (填代号)。
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.精铜作阴极,电解后电解液中Cu2+浓度减小
d.粗铜精炼时通过的电量与阴极析出铜的量无确定关系
(6)从浓硫酸、浓硝酸、蒸馏水中选用合适的试剂,测定粗铜样品中金属铜的质量分数,涉及的主要步骤为:称取一定质量的样品→ →过滤、洗涤、干燥→称量剩余固体铜的质量。(填缺少的操作步骤,说出主要操作方法,不必描述操作过程的细节)
【答案】(1)过滤;坩埚;
(2)Fe2+;Cu+2Fe3+===Cu2++2Fe2+;硫氰化钾溶液和新制氯水或铁氰化钾溶液;
(3)2Al+Fe2O3![]() 2Fe+Al2O3;(4)11;
2Fe+Al2O3;(4)11;
(5)b c;(6)将浓硫酸用蒸馏水稀释,使样品与足量稀硫酸充分反应。
【解析】试题分析:(1)操作I得到液体和固体,因此操作步骤为过滤;灼烧固体需要在坩埚中进行,因此缺少的是坩埚;
(2)Cu2O在酸性条件生成Cu,Fe2O3+6H+=2Fe3++3H2O,Cu+2Fe3+=Cu2++2Fe2+,因此铁元素以Fe2+形式存在;检验Fe2+:先加KSCN溶液,观察溶液颜色,然后再加氯水,如果溶液变为红色,说明含有Fe2+,也可以用K3Fe(CN)6,如果产生蓝色沉淀,说明有Fe2+;
(3)焊接钢轨,采用铝热反应,即2Al+Fe2O3![]() 2Fe+Al2O3;
2Fe+Al2O3;
(4)设pH=x,NaOH溶液中水电离出c(OH-)=c(H+)=10-x,则NaAlO2中水电离的c(OH-)=10(8-x),NaAlO2的pH=10-14/10(8-x)=10(x-22),两者pH相等,则有x=22-x,解得x=11;
(5)a、电解过程一部分能量转化成热能,故错误;b、精炼铜时,粗铜作阳极,发生氧化反应,纯铜作阴极,化合价降低,发生还原反应,故正确;c、粗铜中含有锌、铁等杂质,Zn-2e-=Zn2+,阴极上:Cu2++2e-=Cu,溶液Cu2+略有降低,故正确;d、阴极:Cu2++2e-=Cu,能够得到通过的电量和析出铜的量的关系,故错误;(6) 将浓硫酸用蒸馏水稀释,使样品与足量稀硫酸充分反应。

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案【题目】将一定量的氨基甲酸置于恒容的密闭真空容器中(固体体积忽略不计),使其达到化学平衡:H2NCOONH4(s)![]() 2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表
温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
平衡气体总浓度/10-3mol/L | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
下列有关叙述正确的是
A. 在低温下该反应能自发进行
B. 15℃时,该反应的化学平衡常数约为2.0
C. 当混合气体平均相对分子质量不变时,该反应达到化学反应限度
D. 恒温条件下,向原平衡体系中再充入2molNH3和1molCO2,达平衡后CO2浓度不变