题目内容
已知银元素在元素周期表中位于第5周期,与铜元素同族.下列说法正确的是( )
| A、基态Cu+的电子排布式为1s22s22p63s23p63d94s1 | B、基态Ag原子的价电子排布式为5s1 | C、银元素位于元素周期表第5周期IB族,所以在化合物中通常显+1价 | D、铜元素位于元素周期表第4周期ⅡB族,所以在化合物中通常显+2价 |
分析:A.原子变成阳离子时先失去最外层电子;
B.银原子的价电子排布式包含4d能级上电子;
C.银元素位于第5周期第IB族;
D.铜元素位于第四周期第IB族.
B.银原子的价电子排布式包含4d能级上电子;
C.银元素位于第5周期第IB族;
D.铜元素位于第四周期第IB族.
解答:解:A.基态Cu+的电子排布式为1s22s22p63s23p63d10,故A错误;
B.基态Ag原子的价电子排布式为4d105s1,故B错误;
C.银元素位于第5周期第IB族,最外层电子易失去,所以在化合物中通常显+1价,故C正确;
D.铜元素在元素周期表中位于第四周期第IB族,故D错误;
故选C.
B.基态Ag原子的价电子排布式为4d105s1,故B错误;
C.银元素位于第5周期第IB族,最外层电子易失去,所以在化合物中通常显+1价,故C正确;
D.铜元素在元素周期表中位于第四周期第IB族,故D错误;
故选C.
点评:本题考查原子结构,明确元素结构及其在周期表中的位置是解本题关键,注意原子变成阳离子时失电子顺序,为易错点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目

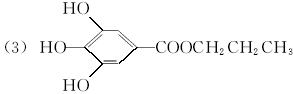 (其中:—X、—Y均为官能团)。
(其中:—X、—Y均为官能团)。 等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)、③BaCl2,这3种试剂添加的合理顺序是_________(填序号);
等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)、③BaCl2,这3种试剂添加的合理顺序是_________(填序号);
