题目内容
【题目】(1)用系统命名法给下列有机物命名:
CH3CH2C(CH3)2CH2CH3_________________________________________
化合物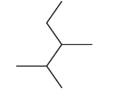 按系统命名法命名__________________________
按系统命名法命名__________________________
2,3-二甲基-4-乙基-2-庚烯的结构简式__________________________
(2)分子式为C4H8O2能发生水解反应的同分异构体有_____种,甲苯的一氯代物有______种。
(3)从某些植物树叶提取的挥发油中含有下列主要成分
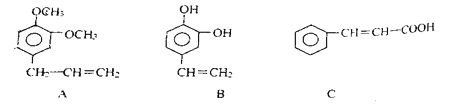
A的分子式是___________,B中的含氧官能团是____________。
【答案】3,3-二甲基戊烷 2,3-二甲基戊烷 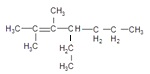 四 四 C11H14O2 酚羟基
四 四 C11H14O2 酚羟基
【解析】
(1)最长的碳链为主链含有5个碳原子,称为戊烷,从靠近支链的一端开始编号,要求支链的位次和最小,因此两个支链的位置为3、3,故命名为3,3-二甲基戊烷。最长的碳链为主链含有5个碳原子,称为戊烷,两个支链的位置为2、3,故命名为2,3-二甲基戊烷。2,3-二甲基-4-乙基-2-庚烯是主链上有7个碳原子,且2、3号碳原子上取代甲基,4号碳原子上取代乙基,并且2、3号碳原子之间含有C=C,故结构简式为: 故答案为:3,3-二甲基戊烷,2,3-二甲基戊烷,
故答案为:3,3-二甲基戊烷,2,3-二甲基戊烷, ;
;
(2)因为分子式为C4H8O2可发生水解,所以它一定是酯类。同分异构体有四种,1. HCOOCH2CH2CH3 甲酸丙酯2. HCOOCH(CH3)CH3 甲酸异丙酯3. CH3COOCH2CH3 乙酸乙酯4, CH3CH2COOCH3 丙酸甲酯,甲苯的一氯代物可在甲基上取代1种和苯环上取代3种,故共有四种,故答案为:四,四;
(3)由A的结构简式可知分子式为C11H14O2,B中的含氧官能团是酚羟基,故答案为:C11H14O2,酚羟基。

 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案【题目】氮的化合物是重要的工业原料,也是主要的大气污染来源,研究氮的化合物的反应具有重要意义。回答下列问题:
(1)肼(N2H4)与四氧化二氮分别是火箭发射器中最常用的燃料与氧化剂。已知3.2g液态肼与足量液态四氧化二氮完全反应,生成氮气和液态水放出热量61. 25 kJ,则该反应的热化学方程式为____。
(2)尾气中的NO2可以用烧碱溶液吸收的方法来处理,其中能生成NaNO2等物质,该反应的离子方程式为____。
(3)在773 K时,分别将2.00 mol N2和6.00 mol H2充入一个固定容积为1 L的密闭容器中发生反应生成NH3,气体混合物中c(N2)、c(H2)、c(NH3)与反应时间(t)的关系如图所示。
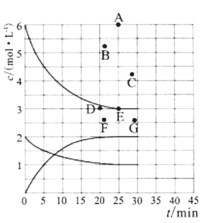
①下列能说明反应达到平衡状态的是____(选填字母)。
a.v正(N2)=3v逆(H2) b.体系压强不变
c.气体平均相对分子质量不变 d.气体密度不变
②在此温度下,若起始充入4. 00 mol N2和12. 00 mol H2,则反应刚达到平衡时,表示 c(H2)~t的曲线上相应的点为 ___(选填字母)。
(4)在373 K时,向体积为2L的恒容真空容器中充入0.40mol NO2,发生如下反应:![]()
测得NO2的体积分数[φ(NO2)]与反应时间(t)的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 |
φ(NO2) | 1.0 | 0.75 | 0.52 | 0.40 | 0.40 |
①计算0~20min时,v(N2O4)=____。
②已知该反应![]() ,其中k1、k2为速率常数,则373K时,
,其中k1、k2为速率常数,则373K时,![]() =_____;改变温度至T1时,k1=k2,则T1___ 373 K(填“>”“<”或“=”)。
=_____;改变温度至T1时,k1=k2,则T1___ 373 K(填“>”“<”或“=”)。
【题目】海水是一个巨大的化学资源宝库,利用海水可以获得很多化工产品。
(1)海水淡化的方法有蒸馏法、________________________(填1种方法)。
(2)海水中制得的饱和氯化钠溶液可以利用电解法直接制取次氯酸钠,制取的离子方程式为____。
(3)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去):

将Br2与Na2CO3反应的化学方程式补充完整:
___Br2+___Na2CO3===___NaBrO3+___ ________+___ ________
(4)盐卤蒸发冷却后析出卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+、Mn2+等离子。以卤块为原料制得镁的工艺流程如下(部分操作和条件已略去):

已知:常温下0.010 mol·L-1金属离子在不同pH下的沉淀情况如下:
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH)2 | 9.6 | 11.1 |
①步骤②中需控制pH=9.8,其目的是_____________。
②NaClO还能除去盐卤中的CO(NH2)2,生成盐和一种能参与大气循环的物质。除去0.2 mol CO(NH2)2时消耗NaClO ________g。
【题目】在温度t1和t2下,卤素单质X2(g)和H2反应生成HX的化学平衡常数如下表,仅根据下表数据不能判断的是( )
化学方程式 | K(t1) | K(t2) |
F2+H2 | 1.8×1036 | 1.9×1032 |
Cl2+ H2 | 9.7×1012 | 4.2×1011 |
Br2+H2 | 5.6×107 | 9.3×106 |
I2+H2 | 43 | 34 |
A.已知t2>t1,HX的生成反应为放热反应
B.在相同条件下, X2平衡转化率:F2>Cl2
C.X2的活泼性随原子序数递增逐渐减弱
D.2F2+2H2![]() 4HF K(t1)=3.6×1036
4HF K(t1)=3.6×1036




