题目内容
二甲醚(CH3OCH3)是一种新型能源,它清洁、高效.工业合成氨时可联产二甲醚,一定条件下,在容积固定的密闭设备中发生反应:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g);△H<0.
CH3OCH3(g)+3H2O(g);△H<0.
(1)若其它条件不变,升高反应设备的温度,H2的转化率
(2)相同温度下,在两个设备中进行上述反应,某时刻设备中各气态物质的浓度及正逆反应速率关系如下表所示.
①判断设备 I中的反应是否达到平衡状态
②推测表中空格处v(正)与v(逆)的关系,并写出推测过程)
(3)若起始时CO2和H2的物质的量比为1:3,某一时刻从上述正在进行的反应设备中分离走H2和H2O,得到CO2(g)和CH3OCH3(g)的混合物.测算出该混合物中C、O两原子的物质的量比n(C):n(O)=1:x,画出以x为横坐标、上述反应中H2(g)的转化率为纵坐标的
的图象(直线).
 CH3OCH3(g)+3H2O(g);△H<0.
CH3OCH3(g)+3H2O(g);△H<0.(1)若其它条件不变,升高反应设备的温度,H2的转化率
减少
减少
(填“增大”、“减少”、“不变”);若不改变反应设备的温度、不增大设备的压强,能提高二甲醚产率的措施有(写一条)及时分离出二甲醚或水
及时分离出二甲醚或水
;(2)相同温度下,在两个设备中进行上述反应,某时刻设备中各气态物质的浓度及正逆反应速率关系如下表所示.

①判断设备 I中的反应是否达到平衡状态
是
是
(填“是”或“否”),该温度下的平衡常数K=1
1
;②推测表中空格处v(正)与v(逆)的关系,并写出推测过程)
该反应的平衡常数K=1.0,而设备 II中Qc=c(CH3OCH3)?c3(H2O)/c2(CO2)?c6(H2)
=1.0×10-4×(2.0×10-4)3/(2.0×10-2)2(1.0×10-2)6
=2.0,∴Qc>K,反应正在向逆反应方向进行,v(正)<v(逆)
=1.0×10-4×(2.0×10-4)3/(2.0×10-2)2(1.0×10-2)6
=2.0,∴Qc>K,反应正在向逆反应方向进行,v(正)<v(逆)
该反应的平衡常数K=1.0,而设备 II中Qc=c(CH3OCH3)?c3(H2O)/c2(CO2)?c6(H2)
=1.0×10-4×(2.0×10-4)3/(2.0×10-2)2(1.0×10-2)6
=2.0,∴Qc>K,反应正在向逆反应方向进行,v(正)<v(逆)
;=1.0×10-4×(2.0×10-4)3/(2.0×10-2)2(1.0×10-2)6
=2.0,∴Qc>K,反应正在向逆反应方向进行,v(正)<v(逆)

(3)若起始时CO2和H2的物质的量比为1:3,某一时刻从上述正在进行的反应设备中分离走H2和H2O,得到CO2(g)和CH3OCH3(g)的混合物.测算出该混合物中C、O两原子的物质的量比n(C):n(O)=1:x,画出以x为横坐标、上述反应中H2(g)的转化率为纵坐标的
的图象(直线).
分析:(1)升高温度化学平衡向着吸热方向进行,根据平衡移动原理来判断提高二甲醚产率的措施;
(2)①平衡状态的标志是:正逆反应速率相等,根据平衡常数表达式来计算平衡常数;
②根据任意态的浓度熵和平衡常数的关系来判断是否是平衡状态以及反应的移动方向;
(3)根据物质的分子构成以及物质成分结合化学平衡移动来画图.
(2)①平衡状态的标志是:正逆反应速率相等,根据平衡常数表达式来计算平衡常数;
②根据任意态的浓度熵和平衡常数的关系来判断是否是平衡状态以及反应的移动方向;
(3)根据物质的分子构成以及物质成分结合化学平衡移动来画图.
解答:解:(1)若其它条件不变,升高反应设备的温度,平衡逆向移动,所以氢气的转化率减小减少,若不改变反应设备的温度、不增大设备的压强,提高二甲醚产率即平衡正向移动的方法是减少生成物的浓度,即,及时分离出二甲醚或水,故答案为:减少;及时分离出二甲醚或水;
(2)①设备I中正逆反应速率相等的状态是平衡状态,根据平衡常数K=
=
=1,故答案为:是;K=1;
②因为该反应的平衡常数K=1.0,而设备 II中Qc=c(CH3OCH3)?c3(H2O)/c2(CO2)?c6(H2)=1.0×10-4×(2.0×10-4)3/(2.0×10-2)2(1.0×10-2)6=2.0,所以Qc>K,反应正在向逆反应方向进行,v(正)<v(逆),故答案为:因为该反应的平衡常数K=1.0,而设备 II中Qc=c(CH3OCH3)?c3(H2O)/c2(CO2)?c6(H2)=1.0×10-4×(2.0×10-4)3/(2.0×10-2)2(1.0×10-2)6=2.0,所以Qc>K,反应正在向逆反应方向进行,v(正)<v(逆);
(3)根据二氧化碳和乙醚的分子式中碳原子和氧原子的分子构成:二氧化碳中n(C):n(O)=1:2,乙醚中n(C):n(O)=2:1,当x=0.5时,则n(C):n(O)=2:1,此时物质的组成只有乙醚,所以二氧化碳消耗完毕,此时氢气的转化率是100%,当x=2是,则物质的组成是二氧化碳,反应刚开始,所以氢气的转化率为0,即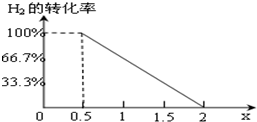 ,故答案为:
,故答案为: .
.
(2)①设备I中正逆反应速率相等的状态是平衡状态,根据平衡常数K=
| [CH3OCH3]?[H2O]3 |
| [CO2]2?[H2]6 |
| (1×10-4)4 |
| (1×10-2)8 |
②因为该反应的平衡常数K=1.0,而设备 II中Qc=c(CH3OCH3)?c3(H2O)/c2(CO2)?c6(H2)=1.0×10-4×(2.0×10-4)3/(2.0×10-2)2(1.0×10-2)6=2.0,所以Qc>K,反应正在向逆反应方向进行,v(正)<v(逆),故答案为:因为该反应的平衡常数K=1.0,而设备 II中Qc=c(CH3OCH3)?c3(H2O)/c2(CO2)?c6(H2)=1.0×10-4×(2.0×10-4)3/(2.0×10-2)2(1.0×10-2)6=2.0,所以Qc>K,反应正在向逆反应方向进行,v(正)<v(逆);
(3)根据二氧化碳和乙醚的分子式中碳原子和氧原子的分子构成:二氧化碳中n(C):n(O)=1:2,乙醚中n(C):n(O)=2:1,当x=0.5时,则n(C):n(O)=2:1,此时物质的组成只有乙醚,所以二氧化碳消耗完毕,此时氢气的转化率是100%,当x=2是,则物质的组成是二氧化碳,反应刚开始,所以氢气的转化率为0,即
 ,故答案为:
,故答案为: .
.点评:本题综合性较强,难度很大,要求学生具有分析和解决问题的能力.

练习册系列答案
相关题目

 CO(g)+3H2(g)……(I)、CO(g)+H2O(g)
CO(g)+3H2(g)……(I)、CO(g)+H2O(g) ×100%,试求反应(Ⅳ)的原子利用率为 。
×100%,试求反应(Ⅳ)的原子利用率为 。
 ×100%,试求反应(Ⅳ)的原子利用率为 。
×100%,试求反应(Ⅳ)的原子利用率为 。
 与H2合成二甲醚的化学方程式为 .
与H2合成二甲醚的化学方程式为 . CO(g)+3H2(g)……(I)、CO(g)+H2O(g)
CO(g)+3H2(g)……(I)、CO(g)+H2O(g) ×100%,试求反应(Ⅳ)的原子利用率为 。
×100%,试求反应(Ⅳ)的原子利用率为 。