题目内容
某研究性学习小组同学设计了如图制取氯气并验证其性质的实验装置.
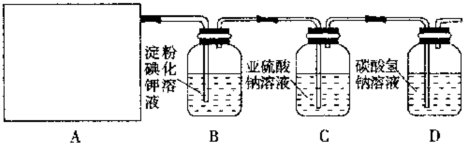
请回答下列问题:
(1)该实验中A部分的装置是
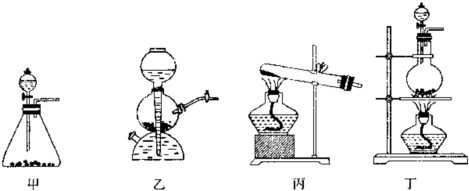
(2)A中发生反应一段时间后,B中的现象是
(3)写出D装置中发生反应的离子方程式:
(4)请你帮该小组同学设计一个实验,证明洗气瓶C中的Na2SO3已被氧化(简述实验步骤):

请回答下列问题:
(1)该实验中A部分的装置是
丁
丁
(填写装置的序号)
(2)A中发生反应一段时间后,B中的现象是
溶液变蓝色
溶液变蓝色
;整套实验装置存在的明显缺陷是无尾气吸收装置
无尾气吸收装置
.(3)写出D装置中发生反应的离子方程式:
Cl2+H2O═H++Cl-+HClO HCO3-+H+═H2O+CO2↑
Cl2+H2O═H++Cl-+HClO HCO3-+H+═H2O+CO2↑
.(4)请你帮该小组同学设计一个实验,证明洗气瓶C中的Na2SO3已被氧化(简述实验步骤):
取少量溶液置于洁净的试管中,向其中加入稀HCl至不再产生气体,再向其中滴入氯化钡溶液,若产生白色沉淀,则证明亚硫酸钠被氧化
取少量溶液置于洁净的试管中,向其中加入稀HCl至不再产生气体,再向其中滴入氯化钡溶液,若产生白色沉淀,则证明亚硫酸钠被氧化
.分析:(1)根据反应物的状态及反应条件选择发生装置.
(2)氯气有氧化性,能和碘化钾反应生成碘单质,根据碘单质的性质分析.氯化氢有刺激性气味,尾气不能直接排空,要用尾气处理装置处理.
(3)氯气和水反应生成盐酸和次氯酸,盐酸能和碳酸氢根离子反应生成二氧化碳.
(4)氯气有强氧化性,亚硫酸根离子有还原性,所以氯气和亚硫酸根离子能发生氧化还原反应生成硫酸根离子、氯离子和氢离子;如果亚硫酸钠被氧化会生成硫酸钠,根据硫酸根离子的检验方法检验即可.
(2)氯气有氧化性,能和碘化钾反应生成碘单质,根据碘单质的性质分析.氯化氢有刺激性气味,尾气不能直接排空,要用尾气处理装置处理.
(3)氯气和水反应生成盐酸和次氯酸,盐酸能和碳酸氢根离子反应生成二氧化碳.
(4)氯气有强氧化性,亚硫酸根离子有还原性,所以氯气和亚硫酸根离子能发生氧化还原反应生成硫酸根离子、氯离子和氢离子;如果亚硫酸钠被氧化会生成硫酸钠,根据硫酸根离子的检验方法检验即可.
解答:解:(1)该反应的反应物是固体和液体,反应条件是加热,所以应选固液混合加热型装置.
故选丁.
(2)氯气有氧化性,能和碘化钾反应生成碘单质和氯化钾Cl2+2KI=2KCl+I2,碘遇淀粉变蓝色.氯化氢有刺激性气味,尾气不能直接排空,要用尾气处理装置进行处理,所以该装置没有尾气处理装置.
故答案为:溶液变蓝色;无尾气处理装置.
(3)氯气和水反应生成盐酸和次氯酸Cl2+H2O?H++Cl-+HClO,盐酸是强酸,能和碳酸氢根离子反应生成二氧化碳和水HCO3-+H+=H2O+CO2↑.
故答案为:Cl2+H2O?H++Cl-+HClO,HCO3-+H+=H2O+CO2↑.
(4)氯气有强氧化性,亚硫酸根离子有还原性,所以氯气和亚硫酸根离子能发生氧化还原反应生成硫酸根离子、氯离子和氢离子Cl2+SO32-+H2O=SO42-+2Cl-+2H+;如果亚硫酸钠被氧化,会生成硫酸钠,硫酸钠和氯化钡能发生 反应生成白色沉淀硫酸钡,亚硫酸钡也是沉淀,所以要先排除亚硫酸盐的干扰,再用氯化钡检验硫酸根离子,检验方法为取少量反应后的溶液于试管中,加入HCl溶液至不再产生气体为止,再滴加BaCl2溶液,如果有白色沉淀生成,证明Na2SO3已被氧化.
故答案为:取少量反应后的溶液于试管中,加入HCl溶液至不再产生气体为止,再滴加BaCl2溶液,如果有白色沉淀生成,证明Na2SO3已被氧化.
故选丁.
(2)氯气有氧化性,能和碘化钾反应生成碘单质和氯化钾Cl2+2KI=2KCl+I2,碘遇淀粉变蓝色.氯化氢有刺激性气味,尾气不能直接排空,要用尾气处理装置进行处理,所以该装置没有尾气处理装置.
故答案为:溶液变蓝色;无尾气处理装置.
(3)氯气和水反应生成盐酸和次氯酸Cl2+H2O?H++Cl-+HClO,盐酸是强酸,能和碳酸氢根离子反应生成二氧化碳和水HCO3-+H+=H2O+CO2↑.
故答案为:Cl2+H2O?H++Cl-+HClO,HCO3-+H+=H2O+CO2↑.
(4)氯气有强氧化性,亚硫酸根离子有还原性,所以氯气和亚硫酸根离子能发生氧化还原反应生成硫酸根离子、氯离子和氢离子Cl2+SO32-+H2O=SO42-+2Cl-+2H+;如果亚硫酸钠被氧化,会生成硫酸钠,硫酸钠和氯化钡能发生 反应生成白色沉淀硫酸钡,亚硫酸钡也是沉淀,所以要先排除亚硫酸盐的干扰,再用氯化钡检验硫酸根离子,检验方法为取少量反应后的溶液于试管中,加入HCl溶液至不再产生气体为止,再滴加BaCl2溶液,如果有白色沉淀生成,证明Na2SO3已被氧化.
故答案为:取少量反应后的溶液于试管中,加入HCl溶液至不再产生气体为止,再滴加BaCl2溶液,如果有白色沉淀生成,证明Na2SO3已被氧化.
点评:本题考查了氯气的实验室制法,难度不大,注意根据反应物的状态和反应条件选择反应发生装置.

练习册系列答案
相关题目
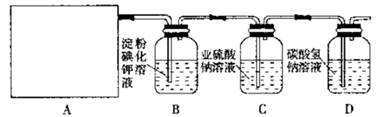
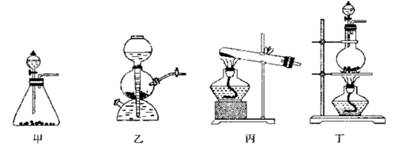
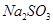 已被氧化(简述实验步骤):
。
已被氧化(简述实验步骤):
。