题目内容
利用废旧镀锌铁皮制备磁性Fe3O4胶体粒子及副产物ZnO,制备流程图如下:
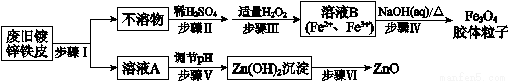
已知:Zn及其化合物的性质与Al及其化合物的性质相似。
(1)步骤Ⅰ中所用的试剂是______________。
(2)步骤Ⅲ中反应的离子方程式是_________________。
(3)步骤Ⅴ可选用的试剂是__________(填序号)。
a.NaOH溶液 b.氨水 c.盐酸
(4)步骤Ⅵ的实验操作是_________________。
氯化亚铜广泛应用于有机合成。工业上以低品位铜矿(主要含CuS、Fe2O3、SiO2)为原料,
制备氯化亚铜的生产工艺如下:
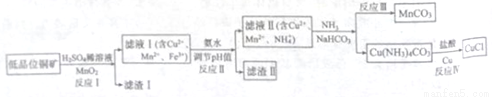
(1)CuS中Cu的化合价为_____________。
(2)滤渣Ⅰ的成分除S之外还有__________,反应Ⅰ中MnO2的作用是______________
(3)已知生成氢氧化物的pH如下表:
沉淀物 | Fe(OH)3 | Mn(OH)2 | Cu(OH)2 |
开始沉淀的pH | 2.7 | 8.3 | 4.2 |
完全沉淀的pH | 3.2 | 9.8 | 6.7 |
则反应Ⅱ中用氨水调节pH值的范围是________________。
(4)检验滤液Ⅱ中是否含有Fe3+的试剂是____________。
(5)请用化学用语回答:
①反应中Ⅲ生成难溶MnCO3的离子方程式_____________;
②反应Ⅳ素所对应的化学方程式____________________。
(6)氯化亚铜的定量分析:
步骤Ⅰ.称取0.2500g的样品和10.0mL 1.0mol/L的FeCl3溶液置于250mL锥形瓶中,不断摇动;
步骤Ⅱ.待样品溶解后,加水10.0mL和3滴指示剂;
步骤Ⅲ.用0.1000mol/L CeOSO4标准溶液滴至终点,并记录读数。重复实验两次,测得数据如下:
序号 | 1 | 2 | 3 |
起始读数 | 0.95mL | 0.70mL | 1.00mL |
终点读数 | 20.95mL | 24.95mL | 21.00mL |
已知:CuCl+FeCl3=CuCl2+FeCl2 Fe2++Ce4+=Fe3++Ce3+
①数据处理:计算CuCl纯度________________;
②误差分析:下列操作会使滴定结果偏高的是__________________。
A.锥形瓶中有少量蒸馏水
B.滴定终点读数时仰视滴定管刻度线,其他操作正确
C.0.1000mol/L CeOSO4溶液久置后浓度变小
D.滴定前滴定管尖嘴有气泡,滴定后气泡消失
E.所取FeCl3溶液体积偏大


 10的微粒只有4种
10的微粒只有4种

