题目内容
A、B、C三种短周期元素在元素周期表中的相对位置如图所示,已知A、C可分别与B形成化合物X和Y,A与B的质子数之和为C的质子数,现有以下说法,其中判断正确的组合是( )

①B与C均存在同素异形体;②X的种类比Y的多③沸点:A的氢化物小于C的氢化物;④C的最高价氧化物对应水化物能与A的氢化物形成三种盐
A.①②③④ B.②③ C.①②④ D.①④

①B与C均存在同素异形体;②X的种类比Y的多③沸点:A的氢化物小于C的氢化物;④C的最高价氧化物对应水化物能与A的氢化物形成三种盐
A.①②③④ B.②③ C.①②④ D.①④
C
试题分析:根据题意可知这三种元素分别是:A是N;B是O;C是P. ①O元素可以形成O2、O3两种单质;P元素可以形成白磷和红磷两种同素异形体。正确。②N元素的氧化物有N2O、NO、N2O3、NO2、N2O4、N2O5,P的氧化物有P2O3、P2O5两种。因此X的种类比Y的多。正确。③NH3、PH3都是由分子构成的物质。分子之间通过分子间作用力结合在一起,由于在NH3分子之间还存在分子间作用力,所以沸点:NH3>PH3。错误。④P的最外层有5电子,最高化合价为+5价,所以最高价氧化物对应水化物是三元酸H3PO4.能与NH3形成NH4H2PO4、(NH4) 2HPO4、(NH4)3PO4三种盐 .正确。因此选项为C.

练习册系列答案
相关题目

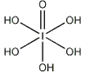 )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4。(填“>”、 “<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4。(填“>”、 “<”或“=”)