��Ŀ����
����Ŀ��ѧ��Ԫ����������֮��ijͬѧ��̽����̼����Ԫ�طǽ����Ե����ǿ�����������ʵ�飺 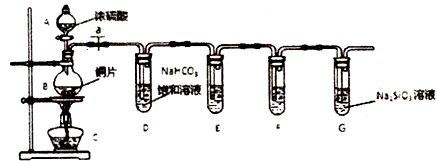
�ش��������⣺
��1����д��ʾ�������ƣ�A��B ��
��2��ʵ�鲽�裺��������������ҩƷ��a��Ȼ�����Ũ���ᣬ���ȣ���ƿ�з�Ӧ�Ļ�ѧ����ʽΪ ��
��3������̽����
���Թ�D�з�����Ӧ�����ӷ���ʽ�� ��
�ڼ�ͬѧ����װ��E����ʢƷ����Һ��ɫ�����Ա仯��F����ʢ����ʯ��ˮ����ǣ��ݴ��϶���Ԫ�صķǽ�����ǿ��̼������ͬѧ��ͬ��Ĺ۵㣬�������� ��
��װ��G�г��ֵ�ʵ������Ϊ �� ����֤��̼Ԫ�صķǽ�����ǿ�ڹ�Ԫ�أ�
���𰸡�
��1����Һ©����Բ����ƿ
��2�����װ�õ������ԣ�Cu+2H2SO4��Ũ�� ![]() CuSO4+SO2��+2H2O
CuSO4+SO2��+2H2O
��3��2HCO3��+SO2=2CO2+SO32��+H2O����������������������Ӧˮ���������ǿ��̼���˵����ķǽ�����ǿ���а�ɫ��������
���������⣺��1������A�Ƿ�Һ©������Һ©���ܿ���Һ�����٣�B��Բ����ƿ��
���Դ��ǣ���Һ©����Բ����ƿ��
��2.�������ӵ�ʵ��װ���ڼ���ҩƷǰҪ���������Լ��飬����ʵ�鲻�ɹ�����ƿ��Cu��Ũ���ᷴӦ��������ͭ�����������ˮ���䷴Ӧ����ʽΪ��Cu+2H2SO4��Ũ�� ![]() CuSO4+SO2��+2H2O�����Դ��ǣ�����װ�������ԣ�Cu+2H2SO4��Ũ��
CuSO4+SO2��+2H2O�����Դ��ǣ�����װ�������ԣ�Cu+2H2SO4��Ũ�� ![]() CuSO4+SO2��+2H2O�� ��3.���ٶ��������̼�����Ʒ�Ӧ�����������ơ�������̼��ˮ���䷴Ӧ�����ӷ���ʽΪ��2HCO3��+SO2=2CO2+SO32��+H2O�����Դ��ǣ�2HCO3��+SO2=2CO2+SO32��+H2O����Ԫ�صķǽ�����Խǿ��������������ˮ��������Խǿ��ǿ���ܺ������η�Ӧ�������ᣬ��������ͨ��Dװ�÷���2HCO3��+SO2=2CO2+SO32��+H2O��˵������������Դ���̼�ᣬ���������������������ˮ������Բ��ܸ�����������̼����������жϷǽ����ԣ����Դ��ǣ���������������������Ӧˮ���������ǿ��̼���˵����ķǽ�����ǿ��������ǿ�����ܺ������η�Ӧ�������ᣬ������̼�����Ʒ�Ӧ���������ԵĹ��ᣬ����G����Һ����ǣ�����˵��̼�����Դ��ڹ��ᣬ��̼Ԫ�صķǽ�����ǿ�ڹ�Ԫ�أ�
CuSO4+SO2��+2H2O�� ��3.���ٶ��������̼�����Ʒ�Ӧ�����������ơ�������̼��ˮ���䷴Ӧ�����ӷ���ʽΪ��2HCO3��+SO2=2CO2+SO32��+H2O�����Դ��ǣ�2HCO3��+SO2=2CO2+SO32��+H2O����Ԫ�صķǽ�����Խǿ��������������ˮ��������Խǿ��ǿ���ܺ������η�Ӧ�������ᣬ��������ͨ��Dװ�÷���2HCO3��+SO2=2CO2+SO32��+H2O��˵������������Դ���̼�ᣬ���������������������ˮ������Բ��ܸ�����������̼����������жϷǽ����ԣ����Դ��ǣ���������������������Ӧˮ���������ǿ��̼���˵����ķǽ�����ǿ��������ǿ�����ܺ������η�Ӧ�������ᣬ������̼�����Ʒ�Ӧ���������ԵĹ��ᣬ����G����Һ����ǣ�����˵��̼�����Դ��ڹ��ᣬ��̼Ԫ�صķǽ�����ǿ�ڹ�Ԫ�أ�
���Դ��ǣ��а�ɫ�������ɣ�
�����㾫����������Ҫ�����˷ǽ�����Ԫ�����ڱ��е�λ�ü������ʵݱ�Ĺ��ɵ����֪ʶ�㣬��Ҫ������Ŀǰ��֪��112��Ԫ���У��ǽ���Ԫ����22�֣���H��ǽ���Ԫ�ض�λ�����ڱ������Ϸ���H�����Ϸ�����F�Ƿǽ�������ǿ��Ԫ�ز�����ȷ�����⣮

 ������ϵ�д�
������ϵ�д� �żӾ���ϵ�д�
�żӾ���ϵ�д�


