题目内容
【题目】25℃时,在20mL,0.1mol·L-1NaOH溶液中逐滴加入0.2mol·L-1醋酸溶液,曲线如图所示,有关粒子浓度关系的比较中,不正确的是
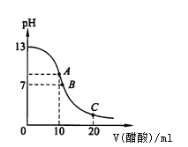
A. 在C点:c(CH3COO-)﹥c(Na+)﹥c(H+) ﹥c(OH-)
B. 在C点:c(CH3COO-)+c(CH3COOH)﹦2 c(Na+)
C. 在B点:c(OH-)﹦c(H+),c(Na+)﹦c(CH3COO-)
D. 在A点:c(Na+)﹥c(OH-)﹥c(CH3COO-)﹥c(H+)
【答案】D
【解析】
A.由中和反应方程式CH3COOH+NaOH=CH3COONa+H2O可知,当加入醋酸溶液体积为20mL时,C点所得溶液中溶质为CH3COONa和CH3COOH,且CH3COONa和CH3COOH物质的量浓度相同,因溶液中醋酸发生电离CH3COOH![]() CH3COO-+H+,CH3COONa发生水解:CH3COO-+H2O
CH3COO-+H+,CH3COONa发生水解:CH3COO-+H2O![]() CH3COOH+OH-,且由图像知C点显酸性,说明醋酸的电离程度大于醋酸钠的水解程度,所以C点溶液中离子浓度大小关系为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),A项正确;
CH3COOH+OH-,且由图像知C点显酸性,说明醋酸的电离程度大于醋酸钠的水解程度,所以C点溶液中离子浓度大小关系为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),A项正确;
B.由A项分析知,C点溶液是等浓度的CH3COONa和CH3COOH的混合溶液,根据物料守恒可得c(CH3COO-)+c(CH3COOH)=2c(Na+),B项正确;
C.由图像知B点溶液显中性,且加入了超过10mL的醋酸溶液,故B点溶液是CH3COONa和CH3COOH的混合溶液,溶液中有c(H+)=c(OH-),根据电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),将两等式相减得c(Na+)=c(CH3COO-),C项正确;
D.由图像知A点溶液中加入了10mL醋酸溶液,根据反应方程式CH3COOH+NaOH=CH3COONa+H2O可知,此时NaOH与CH3COOH恰好完全反应,即A点是CH3COONa溶液,由于CH3COONa的水解CH3COO-+H2O![]() CH3COOH+OH-,且水解是微弱的,所以A点溶液中离子浓度大小关系为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),D项错误;答案选D。
CH3COOH+OH-,且水解是微弱的,所以A点溶液中离子浓度大小关系为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),D项错误;答案选D。

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案【题目】常温常压下,两个容积相同的烧瓶中分别盛满X和Y两种气体,打开开关a,使两烧瓶内的气体相通,最后容器内的压强由大到小的顺序排列正确的是
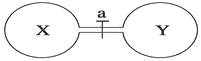
编号 | ① | ② | ③ | ④ |
气体X | HI | NH3 | H2 | NO |
气体Y | Cl2 | HCl | Cl2 | O2 |
A. ②>③>①>④ B. ③>①=④>②
C. ③>①>④>② D. ④>①>②>③