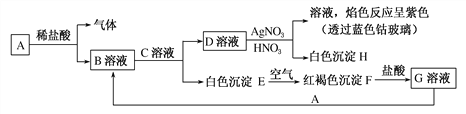
题目内容
【题目】(1)已知:2SO2(g)+ O2(g)= 2SO3(g) △H =-196.6kJ·mol-1
2NO(g)+O2=2NO2(g) △H =-113.0kJ·mol-1
则反应NO2(g)+SO2(g)=SO3(g)+NO(g)的△H = __________。
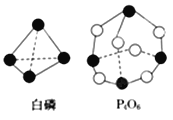
(2)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能:E(P-P)=198kJ·mol-1、E(P-O)=360kJ·mol-1、E(O=O)=498kJ·mol-1,则反应P4(白磷)燃烧生成P4O6的热化学方程式为:___________________。
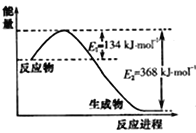
(3)如图是1molNO2(g)和1molCO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,请写出NO2和 CO反应的热化学方程式: 。
【答案】(1)-41.8 kJ·mol-1;
(2)P4(s)+3O2(g)=P4O6(s) △H =-1638 kJ·mol-1;
(3)NO2(g)+CO(g)=CO2(g)+NO(g) △H =-234 kJ/mol。
【解析】
试题分析:(1)①2SO2(g)+ O2(g)= 2SO3(g),②2NO(g)+O2=2NO2(g),(①-②)/2得出NO2(g)+SO2(G0=SO3(g)+NO(g) △H=(-196.6+113)/2kJ·mol-1=-41.8kJ·mol-1;(2)白磷燃烧的反应方程式为 P4+3O2=P4O6,△H=(6×198+3×498-12×360)kJ·mol-1=-1638kJ·mol-1,P4(s)+3O2(g)=P4O6(s) △H =-1638 kJ·mol-1;(3)反应物的总能量大于生成物的总能量,此反应是放热反应,因此有:NO2(g)+CO(g)=CO2(g)+NO(g) △H=E1-E2=(134-368)kJ·mol-1=-234kJ·mol-1,NO2(g)+CO(g)=CO2(g)+NO(g) △H =-234 kJ/mol。

 名校课堂系列答案
名校课堂系列答案