题目内容
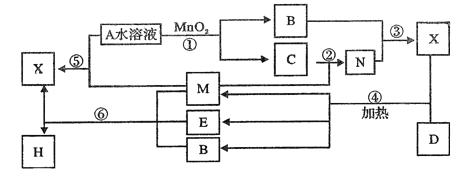
【题目】已知化合物A与B,M与N的元素组成相同,且四种物质中含有同一种元素,A与B在常温下均呈液态。D为生活中用途最广泛的金属单质,与X的浓溶液在常温作用无明显现象,加热时有大量气体产生。(相关转化中所有反应物与生成物均已标出)
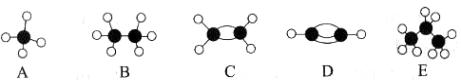
(1)A的结构式_________________,E的化学式为______________。
(2)在①至⑥的化学反应中,属于非氧化还原反应的化合反应为(填序号)__________________。
(3)写出下列反应的化学方程式②_______________,④________________。
(4)写出⑥的离子方程式:_____________________。
(5)将含有1.2molH的水溶液调节至中性, 通入足量C充分反应,生成红褐色沉淀且溶液呈黄色,所得沉淀经过滤、洗涤、灼烧至恒重,称量所得固体的质量为___________________。
【答案】(1)H-O-O-H ;Fe2(SO4)3(2)③
(3)2 SO2+O2![]() 2SO3;2 Fe+6H2SO4(浓)
2SO3;2 Fe+6H2SO4(浓) ![]() Fe2(SO4)3+3SO2↑+6H2O
Fe2(SO4)3+3SO2↑+6H2O
(4)2Fe3++2H2O+SO2=SO42-+2Fe2++4H+(5)32g
【解析】
试题分析:A、B均为液体,且组成相同,可能是H2O和H2O2,H2O2在MnO2催化下可分解生成水和O2,故A为H2O2,B为H2O,C为O2;固体单质D与X的浓溶液在常温下不反应,加热时反应生成M、E和H2O,M能与O2反应,D与E溶液能够发生化合反应,且反应前后溶液颜色有变化,则D为Fe,M为SO2,E为Fe2(SO4)3,N为SO3,X为H2SO4。
(1)A为H2O2,结构式为H-O-O-H,E为Fe2(SO4)3,故答案为:H-O-O-H ;Fe2(SO4)3;
(2)在①至⑥的化学反应中,属于非氧化还原反应的化合反应为③,故答案为:③;
(3)反应②二氧化硫的催化氧化,反应的化学方程式为2 SO2+O2![]() 2SO3,反应④铁和浓硫酸的反应,反应的化学方程式为2 Fe+6H2SO4(浓)
2SO3,反应④铁和浓硫酸的反应,反应的化学方程式为2 Fe+6H2SO4(浓) ![]() Fe2(SO4)3+3SO2↑+6H2O,故答案为:2SO2+O2
Fe2(SO4)3+3SO2↑+6H2O,故答案为:2SO2+O2![]() 2SO3;2 Fe+6H2SO4(浓)
2SO3;2 Fe+6H2SO4(浓) ![]() Fe2(SO4)3+3SO2↑+6H2O;
Fe2(SO4)3+3SO2↑+6H2O;
(4)反应⑥为Fe2(SO4)3氧化二氧化硫的反应,反应的离子方程式为2Fe3++2H2O+SO2=SO42-+2Fe2++4H+,故答案为:2Fe3++2H2O+SO2=SO42-+2Fe2++4H+;
(5)H为FeSO4,通入氧气,生成红褐色沉淀且溶液呈棕黄色,最后得到Fe(OH)3和Fe2(SO4)3,由质量守恒可知1.2molFeSO4可生成0.4molFe(OH)3和0.4molFe2(SO4)3,0.4molFe(OH)3灼烧分解可得到0.2molFe2O3,质量为0.2mol×160g/mol=32g,故答案为:32g。

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案【题目】提纯下列物质所选用的除杂质试剂与主要分离方法都正确的是(括号内为少量杂质),
不纯物质 | 除杂试剂 | 分离方法 | |
A | 苯(甲苯) | KMnO4(酸化),NaOH溶液 | 分液 |
B | NH4Cl溶液(FeCl3) | NaOH溶液 | 过滤 |
C | 乙酸乙酯(乙酸) | KOH溶液 | 分液 |
D | 苯(苯酚) | 浓Br2水 | 过滤 |