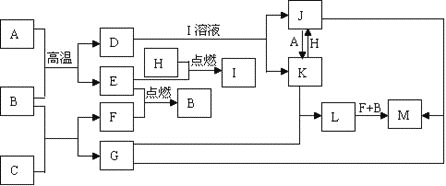
��Ŀ����
����Ŀ����ʯ�㷺��������PVC��ά���ڵȣ���ʯ��ˮ��Ӧ���ò���������ʯ������Ҫ��Ca(OH)2��CaCO3�������������ʡ�ij��ҵ��ʯ���ļ��ֻ��������������£�
����������ˮ�е��ܽ��������ͼ���ش��������⣺
��1�������Ȼ�
����Ӧ�Ļ�ѧ����ʽ�� ��
�����Cl2ת��ΪCa(ClO)2��ת���ʿ��еĴ�ʩ��_______������ţ���
A. ���������¶� B. �ʵ�����ͨ��Cl2����
C. ��ֽ��转�� D. ��ˮʹCa(OH)2��ȫ�ܽ�
����ʯ���е��к�����CN����ClO����Ӧת��Ϊ�����������壬ÿת��1 mol CN��������Ҫ����������ClO��__________mol��
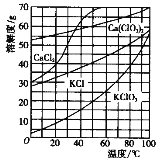
��2��75 ���Ȼ�
����������������Ļ��ϼ�Ϊ ���Ȼ���ɺ��������������Ҫ�ɷ�Ϊ______���ѧʽ����
�����������KCl��Ӧת��Ϊ����ص�ԭ���� ��
��3���л���Ӧ
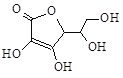
���������ȴ��Ҵ�����ṹ��ʽΪ ���ȴ��Ҵ�����Ca(OH)2��Ӧ�����������顣�ܷ�Ӧ�Ļ�ѧ����ʽ�� ��
���𰸡���1���� 2Cl2��2Ca(OH)2==CaCl2��Ca(ClO)2��2H2O��2����
�� BC��2���� �� 2.5��2����
��2���� +5�ۣ�1���� CaCO3��Ca(OH)2��2����
�� 75 ��������ص��ܽ�ȱ�����ơ��Ȼ��ء��Ȼ��ƶ�С�ö���2����
��3��ClCH2CH2OH��1����
CH2=CH2��Cl2��Ca(OH)2����![]() ��CaCl2��H2O��2����
��CaCl2��H2O��2����
��������
�����������1���������Ȼ�����Ư��Һ�ķ���ʽΪ2Cl2��2Ca(OH)2==CaCl2��Ca(ClO)2��2H2O��
��A. ���������¶�����ת��Ϊ�������A������B. �ʵ�����ͨ��Cl2�����������ת���ʣ�B��ȷ��C. ��ֽ��转��������Ӧ��Ӵ���������ת���ʣ�C��ȷ��D. ��ˮʹCa(OH)2��ȫ�ܽ�Ũ����С������ת����D��������ѡBC��
����ʯ���е��к�����CN����ClO����Ӧת��Ϊ�����������壬������CO2�͵��������ÿת��1 mol CN��ת��5mol�����������������Ӧ�еõ�2�����ӣ�ת��Ϊ�����ӣ����������Ҫ����������ClO��2.5mol��
��2������������������Ļ��ϼ�Ϊ��5�ۡ�̼������ܣ����������ܣ������Ȼ���ɺ��������������Ҫ�ɷ�ΪCaCO3��Ca(OH)2���������ܽ������ͼ��֪75 ��������ص��ܽ�ȱ�����ơ��Ȼ��ء��Ȼ��ƶ�С�ö࣬�������������KCl��Ӧת��Ϊ����ء�
��3�������ȴ��Ҵ�����Ӧ��1����ԭ�ӱ��ǻ�ȡ������ṹ��ʽΪClCH2CH2OH���ȴ��Ҵ�����Ca(OH)2��Ӧ������������������ԭ���غ��֪�ܷ�Ӧ�Ļ�ѧ����ʽ��CH2=CH2��Cl2��Ca(OH)2����![]() ��CaCl2��H2O��
��CaCl2��H2O��