题目内容
有铁和铝的混合物共5.5g,完全溶解于200mL 36.5%的浓盐酸(密度为1.2 g/mL)中,在标准状况下共收集到4.48L H2,求:
(1)浓盐酸的物质的量浓度为 。
(2)铁的质量为 ,铝的质量为 。
(3)将反应后剩余的溶液,用水稀释至500mL,求稀释后溶液中盐酸的物质的量浓度(HCl挥发忽略不计) 。
(1)浓盐酸的物质的量浓度为 。
(2)铁的质量为 ,铝的质量为 。
(3)将反应后剩余的溶液,用水稀释至500mL,求稀释后溶液中盐酸的物质的量浓度(HCl挥发忽略不计) 。
(1)12mol·L-1(2)2.8g 2.7g (3)4mol·L-1
试题分析:(1)根据c=
 可知
可知200mL 36.5%的浓盐酸(密度为1.2 g/mL)溶液的物质的量浓度c=
 =12mol/L
=12mol/L(2)设混合物中铁和铝的物质的量分别是a和b
标准状况下共收集到4.48L H2
则氢气的物质的量n=
 =
=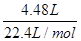 =0.2mol
=0.2mol根据反应的方程式可知
Fe+2HCl=FeCl2+H2↑
1 2 1
a 2a a
2Al+6HCl=2AlCl3+3H2↑
2 6 3
b 3b
 b
b所以56g/mol×a+27g/mol×b=5.5g、a+
 b=0.2mol
b=0.2mol解得x=0.05mol、b=0.1mol
因此铁和铝的质量分别是0.05mol×56g/mol=2.8g、27g/mol×0.1mol=2.7g
(3)原溶液中氯化氢的物质的量=0.2L×12mol/L=2.4mol
反应中消耗氯化氢的物质的量=2a+3b=0.4mol
所以剩余氯化氢的物质的量=2.4mol-0.4mol=2.0mol
因此稀释后溶液中盐酸的物质的量浓度CB=
 =
=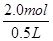 =4mol/L
=4mol/L
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 表示阿伏加德罗常数的值。下列叙述中不正确的是
表示阿伏加德罗常数的值。下列叙述中不正确的是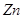 与一定量的浓硫酸反应,产生
与一定量的浓硫酸反应,产生 (标况)气体时,转移的电子数为
(标况)气体时,转移的电子数为
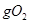 和足量的铁粉充分反应,转移的电子数为
和足量的铁粉充分反应,转移的电子数为
 )的混合物中含有的碳原子数在
)的混合物中含有的碳原子数在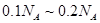 之间
之间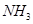 混合气体中含有的氮原子数为
混合气体中含有的氮原子数为