题目内容
【题目】X,Y,Z三种短周期元素,它们的原子序数之和等于16,X2,Y2,Z2在常温下都是无色气体,它们均为工业合成某化工产品的重要原料,其流程如下:
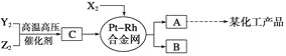
已知:①一定条件下,X2与Y2能反应生成A,X2与Z2能反应生成B;
②B和C分子均为常见的10电子微粒。
请回答下列问题:
(1)X元素在周期表中的位置是___________________________________________;
(2)X2与Z2可制成新型化学电源(KOH溶液作电解质溶液),两个电极均由多孔石墨制成,通入的气体在电极表面放电,负极电极反应式为________________________;
(3)化合物B吸收C后形成的溶液pH______7(填“大于”、“小于”或“等于”),其原因是(用离子方程式表示)___________________________________________________________________;
(4)写出由C生成A和B的化学方程式______________________________。
【答案】第2周期第ⅥA族H2+2OH--2e-=2H2O大于NH3·H2O![]() NH
NH![]() +OH-(或NH3+H2O
+OH-(或NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH
NH![]() +OH-)4NH3+5O2
+OH-)4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
【解析】
![]() ,C分子为常见的10电子微粒,符合
,C分子为常见的10电子微粒,符合![]() ;C是
;C是![]() ,X,Y,Z三种短周期元素,它们的原子序数之和等于16,所以X是O元素;氨气与氧气反应生成NO和
,X,Y,Z三种短周期元素,它们的原子序数之和等于16,所以X是O元素;氨气与氧气反应生成NO和![]() , B为常见的10电子微粒,B是
, B为常见的10电子微粒,B是![]() 、A是NO;O2与Y2能反应生成NO,O2与Z2能反应生成
、A是NO;O2与Y2能反应生成NO,O2与Z2能反应生成![]() ,Z是H元素、Y是N元素。(1)O是8号元素,有2个电子层,最外层6个电子;
,Z是H元素、Y是N元素。(1)O是8号元素,有2个电子层,最外层6个电子;
(2)氢氧燃料电池,负极是氢气失电子发生氧化反应;
(3)水吸收氨气后形成的溶液是氨水,氨水中存在NH3·H2O![]() NH
NH![]() +OH-电离平衡;
+OH-电离平衡;
(4)氨气催化氧化为NO和![]() ;
;
根据以上分析,(1)O是8号元素,有2个电子层,最外层6个电子,所以O元素在周期表中的位置是第2周期第ⅥA族;(2)氢氧燃料电池,负极是氢气失电子发生氧化反应,若以KOH溶液作电解质溶液,负极反应式是H2+2OH--2e-=2H2O;(3)水吸收氨气后形成的溶液是氨水,氨水中存在NH3·H2O![]() NH
NH![]() +OH-电离平衡,所以溶液呈碱性,PH>7;(4)氨气催化氧化为NO和
+OH-电离平衡,所以溶液呈碱性,PH>7;(4)氨气催化氧化为NO和![]() ,反应方程式是4NH3+5O2
,反应方程式是4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;

 阅读快车系列答案
阅读快车系列答案