题目内容
【题目】利用如图装置设计实验,制备SO2并进行探究. 
(1)装置A中反应的化学方程式: .
(2)将A中产生的SO2持续通入装置G中直至过量. ①G中有白色沉淀生成,其化学式为 .
②写出反应初始时SO2被氧化的离子方程式: .
(3)选用A~F中的装置验证H2SO4的酸性强于H2CO3 , 能作为依据的实验现象是: .
(4)要证明H2SO3的酸性强于HClO,所选装置(A~F中)的连接顺序为(填序号): A .
【答案】
(1)Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O
(2)BaSO4;3SO2+2NO3﹣+2H2O=2NO↑+3SO42﹣+4H+
(3)C中品红溶液(或D中KMnO4溶液)不褪色、E中石灰水变浑浊
(4)B→D→C→F
【解析】解:(1)装置A中反应为制备二氧化硫的反应,化学方程式为:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O; 所以答案是:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O;(2)二氧化硫通入D中,被硝酸根氧化为硫酸根,3SO2+2NO3﹣+2H2O=2NO↑+3SO42﹣+4H+ , 与钡离子反应生成硫酸钡沉淀,Ba2++SO42﹣=3 BaSO4↓;所以答案是:①BaSO4;②3SO2+2NO3﹣+2H2O=2NO↑+3SO42﹣+4H+;(3)二氧化硫应该先通入NaHCO3溶液,将生成的气体通入酸性高锰酸钾中吸收二氧化硫气体后,再将气体通入C品红(DKMnO4溶液),品红不褪色(D高锰酸钾),或者E澄清石灰水,澄清石灰水变浑浊,说明生成二氧化碳气体,证明H2SO3>H2CO3 , 又酸性:H2SO4>H2SO3 , 说明H2SO4的酸性强于H2CO3;所以答案是:C中品红溶液(或D中KMnO4溶液)不褪色、E中石灰水变浑浊;(4)要证明H2SO3的酸性强于HClO,因为二氧化硫与次氯酸根离子发生氧化还原反应,不能直接通入漂白粉溶液中,证明酸性H2SO3>H2CO3>HClO即可:应先用二氧化硫制备二氧化碳,制备的二氧化碳中有二氧化硫,故通入漂白粉之前除去二氧化硫气体,再用品红检验二氧化硫是否除净,再通入漂白粉中,故顺序为:A→B→D→C→F;所以答案是:B→D→C→F.

 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案【题目】利用如图所示装置,采用适当试剂可完成下表的探究实验,并得出相应的实验结论,其中错误的是
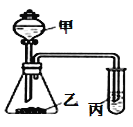
选项 | 甲 | 乙 | __丙 | 装置丙中的现象 | 实验结论 |
A | 稀硝酸 | 碳酸钾 | 澄淸石灰水 | 变浑浊 | 酸性:HNO3>H2CO3 |
B | 稀硫酸 | 碳酸钠 | 次氯酸钙溶液 | 白色沉淀 | 酸性:H2CO3>HClO |
C | 浓盐酸 | 大理石 | 硅酸钠溶液 | 白色沉淀 | 非金属性:C>Si |
D | 浓盐酸 | 高锰酸钾 | 石蕊溶液 | 先变红后褪色 | 氯水既有酸性,又具有漂白性 |
A. A B. B C. C D. D