题目内容
【题目】按要求填空
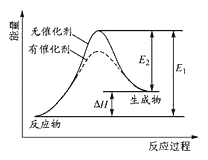
(1)某反应的反应过程中能量变化如图所示,回答下列问题:
E逆反应的活化能___E反应的活化能(填“大于”或“小于”)
(2)50mL 0.50mol/L盐酸与50mL 0.55mo/L NaOH溶夜在如图所示的装置中进行中和反应,逋过测定反应过程中所放出的热量可计算中和热,回答下列问题:
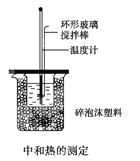
①烧杯间填满碎泡沫塑料作用是________
②实验中改用60mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等“或“不相等”)
【答案】 小于 保温,隔热,防止热量散失 不相等
【解析】(1)由图分析可知,此反应正反应是吸热反应,则E逆反应的活化能小于E反应的活化能;
(2)①测定中和热实验中,要保证容器的绝热,防止热量损失造成的实验误差,需要在烧杯间填满碎泡沫塑料,以达到保温,隔热,防止热量散失;②实验中改用60mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,盐酸与氢氧化钠反应时生成水的量比实验中的大,放出热量肯定不相等,但中和热是一样的。

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目






