题目内容
【题目】亚氯酸钠(NaClO2)主要用于棉纺、造纸业的漂白剂,也用于食品消毒、水处理等。
已知①亚氯酸钠(NaClO2)受热易分解。
②NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O。
③纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
以氯酸钠等为原料制备亚氯酸钠的工艺流程如下:
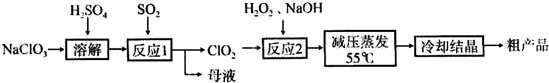
(1)“反应1”需要鼓入空气,空气的作用是_______________
(2)“反应2”的化学方程式为:_______________
(3)采取“减压蒸发”而不用“常压蒸发”,原因是_______________;结晶后需要对晶体洗涤,为了减少损失,可以用_______洗澡晶体。
(4)从“母液”中可回收的主要物质是___________;
(5)要得到纯的亚氯酸钠晶体(NaClO2·3H2O),对粗产品的必须进行的操作名称__________。
【答案】(1)稀释ClO2以防爆炸;(2)H2O2+2ClO2+2NaOH=2NaClO2+2H2O+O2; (3)常压蒸发温度过高,亚氯酸钠容易分解,冰水或酒精;(4)Na2SO4 ; (5)重结晶。
【解析】
试题分析:(1)根据信息③,ClO2易分解爆炸,一般用稀有气体或空气稀释,因此故人空气的目的是稀释ClO2,防止发生爆炸;(2)实验的目的是生成NaClO2,其中Cl显+3价,因此ClO2做氧化剂,H2O2做还原剂,反应方程式为:)H2O2+2ClO2+2NaOH=2NaClO2+2H2O+O2;(3)根据信息①亚氯酸钠受热易分解,温度过高,造成NaClO2分解,因此采用减压蒸发,根据信息②,减少NaClO2的溶解,采用冰水或酒精洗涤;(4)反应1中反生反应是2ClO3-+SO2=2ClO2↑+SO42-,因此母液中可回收的物质是Na2SO4;(5)对粗产品进行重结晶。
