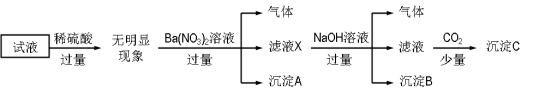
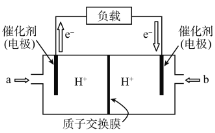
��Ŀ����
����Ŀ�����º�ѹ�£���һ���ݻ��ɱ���ܱ������з�����Ӧ��A(g)��B(g)![]() C(g)������ʼʱͨ��1molA��1molB���ﵽƽ��ʱ����amolC��������˵���������( )
C(g)������ʼʱͨ��1molA��1molB���ﵽƽ��ʱ����amolC��������˵���������( )
A. ����ʼʱͨ��3molA��3molB���ﵽƽ��ʱ�����ɵ�C�����ʵ���Ϊ3amol
B. ����ʼʱͨ��4molA��4molB��2molC���ﵽƽ��ʱ��B�����ʵ���һ������4mol
C. ����ʼʱͨ��2molA��2molB��1molC���ﵽƽ��ʱ����ͨ��3molC�����ٴδﵽƽ���C�����ʵ�������Ϊa/(2-a)
D. ����ԭƽ����ϵ�У���ͨ��1molA��1molB����������ƽ����Է�����������
���𰸡�B
��������
����A�����º�ѹ�£���ʼʱͨ��3 molA��3mol B�뿪ʼʱͨ��1molA��1molB��A��B�����ʵ���֮�ȶ���1��1��Ϊ��Чƽ�⣬��Ӧ���ת������ͬ���ʴﵽƽ��ʱ�����ɵ�C�����ʵ���Ϊ3amol��A��ȷ��B����ʼʱͨ��4 mol A��4 mol B��2 mol C�����ܴ���ƽ��״̬������������Ӧ���У��������淴Ӧ���У��ʴﵽƽ��ʱ��B�����ʵ������ܵ��ڡ�С�ڻ����4 mol��B����C������ʼʱͨ��2molA��2molB��1molC���ﵽƽ��ʱ����ͨ��3molC����ЧΪ��ʼͨ��6molA��6molB���뿪ʼʱͨ��1molA��1molBΪ��Чƽ�⣬C�ĺ�����ͬ����A��g��+B��g��![]() C��g����֪������amolC��������������ʵ�������amol����C�����ʵ�������Ϊ
C��g����֪������amolC��������������ʵ�������amol����C�����ʵ�������Ϊ![]() ��C��ȷ��D������ԭƽ����ϵ�У���ͨ��1molA��1molB����ЧΪ��ʼʱͨ��2molA��2molB����ԭƽ��Ϊ��Чƽ�⣬ƽ��ʱ����ֵĺ������䣬��������ƽ����Է����������䣬D��ȷ����ѡB��
��C��ȷ��D������ԭƽ����ϵ�У���ͨ��1molA��1molB����ЧΪ��ʼʱͨ��2molA��2molB����ԭƽ��Ϊ��Чƽ�⣬ƽ��ʱ����ֵĺ������䣬��������ƽ����Է����������䣬D��ȷ����ѡB��

����Ŀ���й�ʮ�Ŵ�ָ�����ӿ�ˮ��Ⱦ���Ρ�ʵʩ�����ͽ��������ۺ�������������Ⱦ�������ǻ�ѧ�������о�����Ҫ���⣬Ҳ�Ǽ��С���ˮ��ɽ���ǽ�ɽ��ɽ������Ҫ�ٴ롣���ʵ��������£���CO2ת��Ϊ�״������ѵ��л���ȿɽ���CO2��ɵ�����ЧӦ�Ի�����Ӱ�죬���ɵõ���Ҫ���л����
(1)��֪����2H2(g)+O2(g)=2H2O(g) ��H1=484 kJ/mol
��CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ��H2=50 kJ/mol
CH3OH(g)+H2O(g) ��H2=50 kJ/mol
��2CH3OH(g)+3O2(g)= 2CO2(g)+4H2O(g) ��H����H=_____________��
(2)��֪T Kʱ��ij�����ܱ������д������·�Ӧ��2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) ��H<0����������в�ͬʱ��ʱ�����ʵ�Ũ��(mol/L)���±���ʾ��
CH3OCH3(g)+3H2O(g) ��H<0����������в�ͬʱ��ʱ�����ʵ�Ũ��(mol/L)���±���ʾ��
c(CO2) | c(H2) | c(CH3OCH3) | c(H2O) | |
��ʼʱ | a | b | 0 | 0 |
10 sʱ | 3 | 0.5 | c | 1.5 |
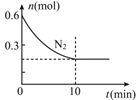
������Ӧ��ʼ��10sʱ����ڣ�v(H2)=_____________��������߷�Ӧ���ʣ��������H2ת���ʵķ�����________________________��
����T Kʱ����ѧƽ�ⳣ��K=15����10 s ʱv(��)_______v(��)���>����<����=��������ʱCO2��ת����Ϊ________��
(3)һ�������£���ij�����ܱ������г���x mol CO2��y mol H2�������ķ�ӦΪCO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ��H=50 kJ��mol1��
CH3OH(g)+H2O(g) ��H=50 kJ��mol1��
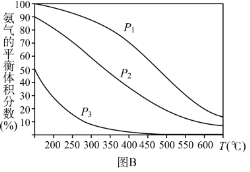
����ͼ1���ܱ�ʾ�÷�Ӧ��ƽ�ⳣ��K���¶�T֮��ı仯��ϵ����Ϊ______���a����b���������ж�������__________________________________��
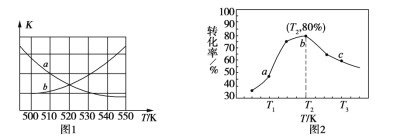
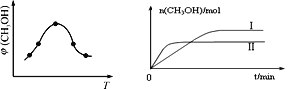
����x=2��y=3���������ͬʱ���ڲ�ͬ�¶���H2��ת������ͼ2��ʾ�����ڸ�ʱ����ڣ�ǡ�ôﵽ��ѧƽ��ʱ�������ڵ�ѹǿ�뷴Ӧ��ʼʱ��ѹǿ֮��Ϊ____________��