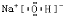题目内容
Q、R、X、Y、Z 为前 18 号元素中的五种,Q 的低价氧化物与 X 单质分子的电子总数相等,R 与 Q 同族,X、Y与Z不同族,Y 和 Z 的阴离子与 Ar 原子的电子结构相同且 Y 的原子序数小于 Z.
(1)在相同条件下,Q 的氢化物在水中的溶解度
(2)R 的氢化物分子的空间构型是
(3)X 的常见氢化物的空间构型是
 ;
;
(4)Q与 Y 形成的化合物中心原子Q的轨道杂化类型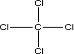
 ,属于
,属于
(1)在相同条件下,Q 的氢化物在水中的溶解度
小于
小于
X的氢化物在水中的溶解度(填“大”“小”或“等于”)原因是水是极性溶剂,根据相似相溶原理
水是极性溶剂,根据相似相溶原理
(2)R 的氢化物分子的空间构型是
正四面体
正四面体
,它与 X 形成的化合物可作为一种重要的陶瓷材料,其化学式是Si3N4
Si3N4
;(3)X 的常见氢化物的空间构型是
三角锥形
三角锥形
;它的另一氢化物 X2H4 是一种火箭燃料的成分,其电子式是

(4)Q与 Y 形成的化合物中心原子Q的轨道杂化类型
sp
sp
;Q和 Z 形成的化合物分子的结构式是

非极性
非极性
分子(填“极性”或“非极性”).分析:Q、R、X、Y、Z 为前18号元素中的五种,Y和Z 的阴离子与Ar原子的电子结构相同,核外电子数为18,且Y的原子序数小于Z,故Y为S元素,Z为Cl元素,X、Y与Z不同族,Q的低价氧化物与X单质分子的电子总数相等,Q可能为C(碳),X为N,R与Q同族,由于这五种元素均是前18号元素,所以R为Si,据此解答.
解答:解:Q、R、X、Y、Z 为前18号元素中的五种,Y和Z 的阴离子与Ar原子的电子结构相同,核外电子数为18,且Y的原子序数小于Z,故Y为S元素,Z为Cl元素,X、Y与Z不同族,Q的低价氧化物与X单质分子的电子总数相等,Q可能为C(碳),X为N,R与 Q同族,由于这五种元素均是前18号元素,所以R为Si,
(1)Q 的氢化物为CH4,为非极性分子,X的氢化物为NH3,为极性分子,水为极性分子,根据相似相溶原理可知甲烷难溶于水,氨气易溶于水,
故答案为:小于;水是极性溶剂,根据相似相溶原理;
(2)R为Si元素,氢化物为SiH4,空间结构与甲烷相同,为正四面体,Si与N元素形成的化合物可作为一种重要的陶瓷材料,其化学式是Si3N4,
故答案为:正四面体;Si3N4;
(3)X为氮元素,常见氢化物为NH3,空间结构为三角锥形,N2H4 的电子式为 ,故答案为:三角锥形,
,故答案为:三角锥形, ;
;
(4)C与S 形成的化合物为CS2,中心原子C形成2个δ键,轨道杂化类型为sp杂化,C和Cl形成的化合物分子的结构式为 ,为正四面体结构,属于非极性分子,故答案为:sp;CCl4;
,为正四面体结构,属于非极性分子,故答案为:sp;CCl4; ;非极性.
;非极性.
(1)Q 的氢化物为CH4,为非极性分子,X的氢化物为NH3,为极性分子,水为极性分子,根据相似相溶原理可知甲烷难溶于水,氨气易溶于水,
故答案为:小于;水是极性溶剂,根据相似相溶原理;
(2)R为Si元素,氢化物为SiH4,空间结构与甲烷相同,为正四面体,Si与N元素形成的化合物可作为一种重要的陶瓷材料,其化学式是Si3N4,
故答案为:正四面体;Si3N4;
(3)X为氮元素,常见氢化物为NH3,空间结构为三角锥形,N2H4 的电子式为
 ,故答案为:三角锥形,
,故答案为:三角锥形, ;
;(4)C与S 形成的化合物为CS2,中心原子C形成2个δ键,轨道杂化类型为sp杂化,C和Cl形成的化合物分子的结构式为
 ,为正四面体结构,属于非极性分子,故答案为:sp;CCl4;
,为正四面体结构,属于非极性分子,故答案为:sp;CCl4; ;非极性.
;非极性.点评:本题考查元素推断、常用化学用语、分子结构等,综合考查原子的结构、性质和位置,侧重于学生分析能力和化学知识的综合运用能力的考查,为高考常见题型,难度中等,推断Q与X元素是解题的关键,可以利用猜测验证进行.

练习册系列答案
 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案
相关题目