题目内容
【题目】常温下,用0.10mol·L-1KOH溶液滴定10.00mL0.10mol·L-1H2C2O4(二元弱酸)溶,所得滴定曲线如图所示(混合溶液的体积可看成混合前溶液的体积之和)。下列说法正确的是( )
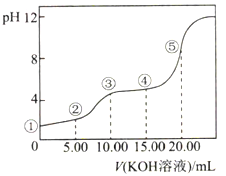
A. 点①所示溶液中:c(H+)/c(OH-)=1012
B. 点②所示溶液中:c(K+)+c(H+)=c(HC2O4-)+c(C2O42-)+c(OH-)
C. 点③所示溶液中:c(K+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
D. 点④所示溶液中:c(K+)+c(H2C2O4)+c(HC2O4-)+ c(C2O42-)=0.10mol·L-1
【答案】D
【解析】
试题A.0.10molL-1H2C2O4(二元弱酸)不能完全电离,点①pH≠1,则![]() ≠1012,故A错误;B.点②为混合溶液,由电荷守恒可知,c(K+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-),故B错误;C.点③溶液显酸性,等体积等浓度反应生成KHC2O4,电离大于其水解,则c(K+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4),故C错误;D.由物料守恒可知,c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.10molL-1,故D正确;故选D。
≠1012,故A错误;B.点②为混合溶液,由电荷守恒可知,c(K+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-),故B错误;C.点③溶液显酸性,等体积等浓度反应生成KHC2O4,电离大于其水解,则c(K+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4),故C错误;D.由物料守恒可知,c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.10molL-1,故D正确;故选D。

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案【题目】某溶液可能含Cl-、SO42-、CO32-、Cu2+、Ba2+和Na+。探究小组为了确定该溶液中离子的组成,取该溶液 100mL 进行以下实验:(填写下表空格)
实验操作与现象 | 实验结论 | 判断理由 | |
步骤一 | 加入过量NaOH溶液,得到蓝色沉淀; | 肯定有 Cu2+、肯定无__________。 | 肯定无该离子的理由_____。 |
步骤二 | 将蓝色沉淀过滤、洗涤、灼烧得到24.0g 固体; | Cu2+物质的量浓度为_____________mol/L | Cu 元素守恒。过滤所用玻璃仪器有烧杯、 ___________________ |
步骤三 | 向上述滤液中加足量Ba(NO3)2溶液,得到46.6g不溶于稀硝酸的沉淀。 | 肯定有Cl-、________; 肯定无Ba2+。 | 相应的离子方程式:___________________________ ,肯定有 Cl-的理由______________ |
若 100mL 溶液中含有 0.3mol Na+,则向步骤三的滤液中加入足量 AgNO3 溶液, 过滤、洗涤、干燥,可得到______________g 白色沉淀[保留小数点后一位]。