题目内容
实验测得常温下0.1mol/L某一元酸(HA)溶液的pH值等于1,0.1mol/L某一元碱(BOH)溶液里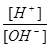 =10-12。将此两种溶液等体积混合后,所得溶液呈的各离子的浓度由大到小排列的顺序是
=10-12。将此两种溶液等体积混合后,所得溶液呈的各离子的浓度由大到小排列的顺序是
A.C(B+)>C(A-)>C(OH-)>C(H+) B.C(A-)>C(B+)>C(H+)>C(OH-)
C.C(B+)=C(A-)>C(H+)=C(OH-) D.C(B+)>C(A-)>C(H+)>C(OH-)
C
解析考点:离子浓度大小的比较;酸碱混合时的定性判断及有关ph的计算.
分析:常温下0.1mol/L某一元酸(HA)溶液的pH等于l,说明HA完全电离,为强酸,0.1mol/L某一元碱(BOH)溶液里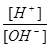 =10-12,结合c(H+)×c(OH-)=10-14,可知c(OH-)=0.1mol/L,则BOH为强碱,二者反应生成强碱强酸盐,溶液呈中性,以此解答该题.
=10-12,结合c(H+)×c(OH-)=10-14,可知c(OH-)=0.1mol/L,则BOH为强碱,二者反应生成强碱强酸盐,溶液呈中性,以此解答该题.
解答:解:常温下0.1mol/L某一元酸(HA)溶液的pH等于l,说明HA完全电离,为强酸,0.1mol/L某一元碱(BOH)溶液里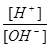 =10-12,结合c(H+)×c(OH-)=10-14,可知c(OH-)=0.1mol/L,则BOH为强碱,二者反应生成强碱强酸盐,溶液呈中性,则c(OH-)=c(H+)=10-7 mol/L,
=10-12,结合c(H+)×c(OH-)=10-14,可知c(OH-)=0.1mol/L,则BOH为强碱,二者反应生成强碱强酸盐,溶液呈中性,则c(OH-)=c(H+)=10-7 mol/L,
C(B+)=C(A-)= 0.1mol/L
故C(B+)=C(A-)>C(H+)=C(OH-) 选C
点评:本题考查离子浓度的大小比较,题目难度中等,解答该题的关键是根据溶液的pH和溶液中氢离子与氢氧根离子判断电解质的强弱.

练习册系列答案
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目
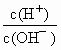 =10-12,将这两种溶液等体积混合后,所得溶液里各离子的物质的量浓度由大到小顺序是
=10-12,将这两种溶液等体积混合后,所得溶液里各离子的物质的量浓度由大到小顺序是