题目内容
【题目】下图所示的四个容器中分别盛有不同的溶液,除a、b外,其余电极均为石墨电极。甲为铅蓄电池,其工作原理为:Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O,其两个电极的电极材料分别为PbO2和Pb。闭合K,发现g电极附近的溶液先变红,20min后,将K断开,此时c、d两极上产生的气体体积相同;据此回答:
2PbSO4+2H2O,其两个电极的电极材料分别为PbO2和Pb。闭合K,发现g电极附近的溶液先变红,20min后,将K断开,此时c、d两极上产生的气体体积相同;据此回答:
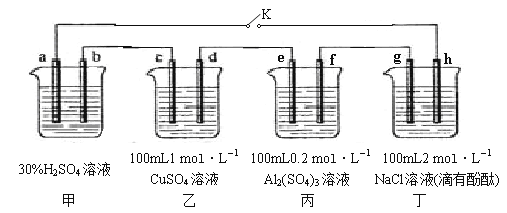
(1)a电极的电极材料是 (填“PbO2”或“Pb”)。
(2)丙装置中发生电解的总反应方程式为 。
(3)电解20min时,停止电解,此时要使乙中溶液恢复到原来的状态,需要加入的物质及其物质的量是 。
(4)20min后将乙装置与其他装置断开,然后在c、d两极间连接上灵敏电流计,发现电流计指针偏转,则此时c电极为 极,d电极上发生反应的电极反应式为 。
(5)电解后取a mL丁装置中的溶液,向其中逐滴加入等物质的量浓度的CH3COOH溶液,当加入b mL CH3COOH溶液时,混合溶液的pH恰好等于7(体积变化忽略不计)。已知CH3COOH的电离平衡常数为1.75×10-5,则a/b = 。
【答案】(1)PbO2,(2分);(2)2H2O![]() 2H2↑+ O2↑(2分);
2H2↑+ O2↑(2分);
(3)0.1molCu(OH)2或0.1molCuO、0.1mol H2O(3分)
(4)负(1分),O2 +4H++4e-=2H2O (2分)
(5)175/176(3分)
【解析】
由于甲池是铅蓄电池,其两个电极的电极材料分别为PbO2和Pb。闭合K,发现NaCl溶液中的g电极附近的溶液先变红,说明该电极附近H+放电,所以g是阴极,h是阳极;则a是电源的正极,b是电源的负极,电极材料a是PbO2,b是Pb。(2)丙装置中是电解Al2(SO4)3溶液,在阳极发生反应:4OH--4e-=2H2O+ O2↑,在阴极发生反应:2H++2e-= H2↑,所以发生的总反应方程式是:2H2O![]() 2H2↑+ O2↑;(3)电解CuSO4溶液,首先在阳极发生反应:4OH--4e-=2H2O+ O2↑,在阴极发生反应:Cu++2e-= Cu,总反应方程式是:2CuSO4+2H2O
2H2↑+ O2↑;(3)电解CuSO4溶液,首先在阳极发生反应:4OH--4e-=2H2O+ O2↑,在阴极发生反应:Cu++2e-= Cu,总反应方程式是:2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4;后来在阴极发生反应:2H++2e-= H2↑,总反应方程式是2H2O
2Cu+O2↑+2H2SO4;后来在阴极发生反应:2H++2e-= H2↑,总反应方程式是2H2O![]() 2H2↑+ O2↑。20min时,将K断开,此时c、d两极上产生的气体体积相同;则根据闭合回路中电子转移数目相等可得4n(O2)=2n(Cu)+2n(H2),n(Cu)=n(CuSO4)=1mol/L×0.1L=0.1mol,n(O2)= n(H2),所以n(O2)=n(H2)=0.1mol,n(Cu)=0.1mol,停止电解,此时要使乙中溶液恢复到原来的状态,需要加入的物质是0.1molCuO、0.1molH2O;(4)20min后将乙装置与其他装置断开,然后在c、d两极间连接上灵敏电流计,由于在c电极有H2,在d电极有氧气,周围有电解质溶液,构成了原电池,因此会发现电流计指针偏转,则此时c电极为负极,d电极上发生反应的电极反应式为O2 +4H++4e-=2H2O;(5)对于丁溶液电解方程式是:2NaCl+2H2O
2H2↑+ O2↑。20min时,将K断开,此时c、d两极上产生的气体体积相同;则根据闭合回路中电子转移数目相等可得4n(O2)=2n(Cu)+2n(H2),n(Cu)=n(CuSO4)=1mol/L×0.1L=0.1mol,n(O2)= n(H2),所以n(O2)=n(H2)=0.1mol,n(Cu)=0.1mol,停止电解,此时要使乙中溶液恢复到原来的状态,需要加入的物质是0.1molCuO、0.1molH2O;(4)20min后将乙装置与其他装置断开,然后在c、d两极间连接上灵敏电流计,由于在c电极有H2,在d电极有氧气,周围有电解质溶液,构成了原电池,因此会发现电流计指针偏转,则此时c电极为负极,d电极上发生反应的电极反应式为O2 +4H++4e-=2H2O;(5)对于丁溶液电解方程式是:2NaCl+2H2O![]() Cl2↑+H2↑+2NaOH,所以反应后的溶液是NaOH溶液,电解后取a mL丁装置中的溶液,向其中逐滴加入等物质的量浓度的CH3COOH溶液,当加入b mL CH3COOH溶液时,混合溶液的pH恰好等于7。根据电荷守恒可知n(Na+)+n(H+)=c(CH3COO-)+c(OH-),由于溶液pH=7,所以n(Na+)=c(CH3COO-),混合溶液体积变化忽略不计,假设NaOH溶液的浓度是mmol/L,则反应后溶液中c(Na+) =c(CH3COO-)=[am/(a+b)]mol/L,c(CH3COOH)=[(bm-am]/(a+b)]mol/L,由于CH3COOH的电离平衡常数为1.75×10-5,所以
Cl2↑+H2↑+2NaOH,所以反应后的溶液是NaOH溶液,电解后取a mL丁装置中的溶液,向其中逐滴加入等物质的量浓度的CH3COOH溶液,当加入b mL CH3COOH溶液时,混合溶液的pH恰好等于7。根据电荷守恒可知n(Na+)+n(H+)=c(CH3COO-)+c(OH-),由于溶液pH=7,所以n(Na+)=c(CH3COO-),混合溶液体积变化忽略不计,假设NaOH溶液的浓度是mmol/L,则反应后溶液中c(Na+) =c(CH3COO-)=[am/(a+b)]mol/L,c(CH3COOH)=[(bm-am]/(a+b)]mol/L,由于CH3COOH的电离平衡常数为1.75×10-5,所以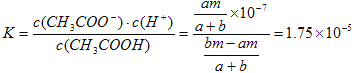 ,解得a/b =175/176。
,解得a/b =175/176。

 一线名师提优试卷系列答案
一线名师提优试卷系列答案【题目】一种高分子化合物(VI)是目前市场上流行的墙面涂料之一,其合成路线如下(反应均在一定条件下进行):

回答下列问题:
(1)目前工业上生产乙烯主要是以 为原料通过 反应来实现。
(2)化合物III生成化合物IV的另外一种产物是 。(提示:该反应的逆反应原子利用率为100%)
(3)写出合成路线中从化合物IV到化合物VI的两步反应的化学方程式: 、 。
(4)下列关于化合物III、IV和V的说法中,正确的是 (填字母)
A.化合物III可以发生氧化反应 |
B.化合物III不可以与NaOH 溶液反应 |
C.化合物IV能与氢气发生加成反应 |
D.化合物III、IV和V均可与金属钠反应生成氢气 |
E.化合物IV和V均可以使溴的四氯化碳溶液褪色