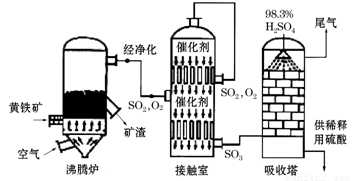
题目内容
以硫酸工艺的尾气、氨水、石灰石、焦炭及碳酸氢铵和KCl为原料可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸氢铵等物质.合成路线如下:

(1)生产过程中,反应Ⅰ中需鼓入足量空气,试写出该反应的总方程式______.
(2)反应Ⅱ中需要向溶液中加入适量的对苯二酚等物质,其可能的作用是______.
(3)反应Ⅲ中氧化剂与还原剂的物质的量之比为______.
(4)反应Ⅴ反应液用40%乙二醇溶液,温度控制在25℃,硫酸钾的产率超过90%,其原因是______.
(5)能用于测得尾气中SO2含量的是______.
A.滴有酚酞的NaOH溶液 B.酸性KMnO4
C.滴有淀粉的碘水 D.BaCl2溶液.
解:(1)碳酸钙、二氧化硫和氧气反应生成硫酸钙和二氧化碳,方程式为2CaCO3+2SO2+O2═2CaSO4+2CO2,故答案为:2CaCO3+2SO2+O2═2CaSO4+2CO2;
(2)对苯二酚具有还原性,空气中的氧气具有氧化性,亚硫酸氨中+4价的硫具有还原性,故答案为:防止亚硫酸铵被氧化;
(3)反应Ⅲ化学方程式为:CaSO4+4C=CaS+4CO↑,氧化剂为CaSO4,还原剂为C,氧化剂与还原剂物质的量之比为1:4,故答案为:1:4;
(4)反应V中选用了40%的乙二醇溶液,温度控制在25℃,此时硫酸钾的产率超过90%,选用40%的乙二醇溶液原因是利用乙二醇降低硫酸钾溶解度,有利于析出,
故答案为:乙二醇是有机溶剂能减小K2SO4的溶解度,使硫酸钾充分析出;
(5)酸性KMnO4与二氧化硫反应的方程式为:5SO2+2MnO4-+2H2O=2Mn2++4H++5SO42-,碘与二氧化硫发生氧化还原的方程式为:SO2+I2+2H2O=H2SO4+2HI,碘消耗完,淀粉因没有碘单质不再显蓝色,故答案为:BC.
分析:(1)根据反应物和生成物写出反应的化学方程式;
(2)亚硫酸氨中的硫为+4价,易被空气中的氧气氧化;
(3)根据元素的化合价变化来分析氧化剂及还原剂,利用化学反应方程式来分析氧化剂与还原剂的物质的量之比;
(4)利用硫酸钾在不同溶剂中溶解度的不同,达到析出晶体的目的;
(5)酸性KMnO4能氧化二氧化硫,且紫色的KMnO4溶液褪色,碘与二氧化硫发生氧化还原反应,淀粉遇碘显蓝色.
点评:本题考查了物质的制备流程分析,反应产物判断,反应条件的选择和原因,仔细审读题意和流程是解题关键,题目难度中等.
(2)对苯二酚具有还原性,空气中的氧气具有氧化性,亚硫酸氨中+4价的硫具有还原性,故答案为:防止亚硫酸铵被氧化;
(3)反应Ⅲ化学方程式为:CaSO4+4C=CaS+4CO↑,氧化剂为CaSO4,还原剂为C,氧化剂与还原剂物质的量之比为1:4,故答案为:1:4;
(4)反应V中选用了40%的乙二醇溶液,温度控制在25℃,此时硫酸钾的产率超过90%,选用40%的乙二醇溶液原因是利用乙二醇降低硫酸钾溶解度,有利于析出,
故答案为:乙二醇是有机溶剂能减小K2SO4的溶解度,使硫酸钾充分析出;
(5)酸性KMnO4与二氧化硫反应的方程式为:5SO2+2MnO4-+2H2O=2Mn2++4H++5SO42-,碘与二氧化硫发生氧化还原的方程式为:SO2+I2+2H2O=H2SO4+2HI,碘消耗完,淀粉因没有碘单质不再显蓝色,故答案为:BC.
分析:(1)根据反应物和生成物写出反应的化学方程式;
(2)亚硫酸氨中的硫为+4价,易被空气中的氧气氧化;
(3)根据元素的化合价变化来分析氧化剂及还原剂,利用化学反应方程式来分析氧化剂与还原剂的物质的量之比;
(4)利用硫酸钾在不同溶剂中溶解度的不同,达到析出晶体的目的;
(5)酸性KMnO4能氧化二氧化硫,且紫色的KMnO4溶液褪色,碘与二氧化硫发生氧化还原反应,淀粉遇碘显蓝色.
点评:本题考查了物质的制备流程分析,反应产物判断,反应条件的选择和原因,仔细审读题意和流程是解题关键,题目难度中等.

练习册系列答案
相关题目