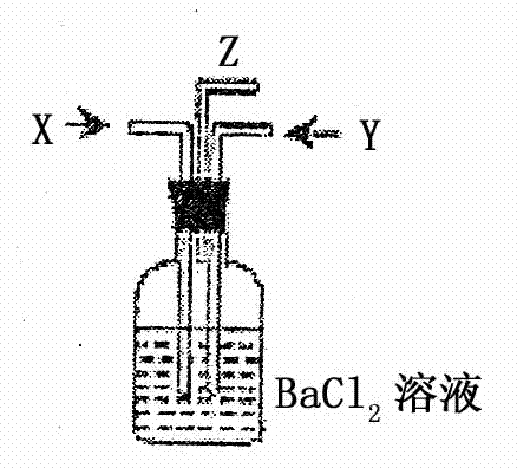
题目内容
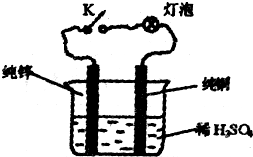 如右图装置,有关下列说法正确的是( )
如右图装置,有关下列说法正确的是( )分析:K处连接时,该装置构成原电池,锌作负极,铜作正极,作原电池负极的金属能加快被腐蚀速率,原电池放电时,电流从正极沿导线流向负极,构成原电池的装置中,能自发的进行氧化还原反应.
解答:解:A.K处连接时,该装置构成原电池,锌作负极,铜作正极,电流从铜棒经导线流入锌棒,故A错误;
B.K处不连接时,不能形成闭合回路,所以该装置不能构成原电池,则该装置中化学能转化为热能,故B正确;
C.K处连不连接,不能形成闭合回路,所以该装置不能构成原电池,则纯锌溶解的速率减小,故C错误;
D.把稀硫酸溶液换成乙醇时,该装置不能自发的进行氧化还原反应,所以实验效果不同,故D错误;
故选B.
B.K处不连接时,不能形成闭合回路,所以该装置不能构成原电池,则该装置中化学能转化为热能,故B正确;
C.K处连不连接,不能形成闭合回路,所以该装置不能构成原电池,则纯锌溶解的速率减小,故C错误;
D.把稀硫酸溶液换成乙醇时,该装置不能自发的进行氧化还原反应,所以实验效果不同,故D错误;
故选B.
点评:不同考查了原电池原理,明确原电池的形成条件是解本题关键,难度不大.

练习册系列答案
相关题目


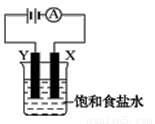
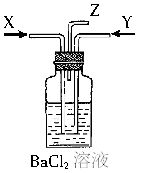 图装置)。下列有关说法错误的是 ()。
图装置)。下列有关说法错误的是 ()。