题目内容
(13分)能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务。阅读下列有关能源的材料,回答有关问题:
(1)从能量的角度看,断开化学键要 ,形成化学键要 。已知拆开1 mol H-H键、1 mol I-I键、1 mol H-I键分别需要吸收的能量为436 kJ、151 kJ、299 kJ。则由氢气和碘反应生成1 mol HI需要 (填“放出”或“吸收”) kJ的热量。
(2)在生产和生活中经常遇到化学能与电能的相互转化。
如右图装置,烧杯中盛有饱和食盐水,X、Y是两块石墨电极,两电极通过导线与直流电源相连,实验开始时,同时在两边各滴入几滴酚酞试液,请回答以下问题:
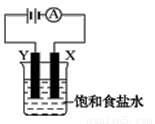
①该装置最主要的能量转化为_________________
②在X电极附近溶液中可观察到的现象是 X电极上发生_______反应(填“氧化”或“还原”),电极反应式为_____________________。
③检验Y电极上产物的方法是 。
④装置的总反应化学方程式是 。
(1)吸收能量 释放能量 放出 5.5 (2分)(2)①电能转化为化学能
②酚酞试液变红,产生无色气泡; 还原;2H2O +2e- = H2↑+ 2OH- 或2H+ +2e- = H2↑(2分)
③用湿润的淀粉碘化钾试纸检验 ④2NaCl+2H2O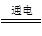 2NaOH+H2↑+Cl2↑ (2分)
2NaOH+H2↑+Cl2↑ (2分)
【解析】(1)从能量的角度看,断开化学键要吸收能量,而形成化学键要放出能量,因此反应热就是断键吸收的能量和形成化学键所放出的能量的差值。所以该反应的反应热是436 kJ/mol+151 kJ/mol-2×299 kJ/mol=-5.5kJ/mol,即该反应是放热反应,放出的能量是5.5kJ。
(2)①根据装置图可知,有外接的电源,所以是电解池,是把电能转化为化学能的。
②X和电源的负极相连,作阴极,溶液中的氢离子放电,发生还原反应生成氢气,方程式为2H+ +2e- = H2↑。由于氢离子放电,破坏了阴极周围水的电离平衡,从而使阴极周围溶液显碱性,因此溶液显红色。
③Y电极和电源的正极相连,作阳极,溶液中的氯离子失去电子,发生氧化反应生成氯气。氯气具有氧化性,可用用湿润的淀粉碘化钾试纸检验。
④根据以上分析可知,总的反应式是2NaCl+2H2O 2NaOH+H2↑+Cl2↑。
2NaOH+H2↑+Cl2↑。

 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案

