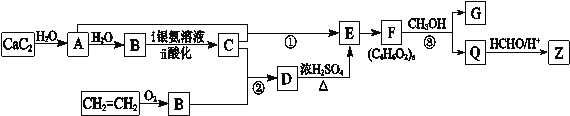
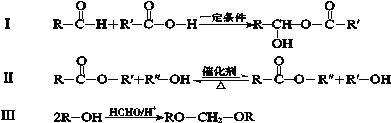
题目内容
【题目】【化学——选修3:物质结构与性质】
物质的结构决定物质的性质。请回答下列涉及物质结构和性质的问题:
(1)第二周期中,元素的第一电离能处于B与N之间的元素有_________种。
(2)某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的价层电子排布式为_________________。
(3)乙烯酮(CH2=C=O)是一种重要的有机中间体,可用CH3COOH在(C2H5O)3P=O存在下加热脱H2O得到。乙烯酮分子中碳原子杂化轨道类型是_____________,1mol(C2H5O)3P=O分子中含有的σ键的数目为__________________。
(4)已知固态NH3、H2O、HF的氢键键能和结构如下:

解释H2O、HF、NH3沸点依次降低的原因___________________。
(5)碳化硅的结构与金刚石类似,其硬度仅次于金刚石,具有较强的耐磨性能。碳化硅晶胞结构中每个碳原子周围与其距离最近的硅原子有________个,与碳原子等距离最近的碳原子有__________个。已知碳化硅晶胞边长为apm,则晶胞图中1号硅原子和2号碳原子之间的距离为________pm,碳化硅的密度为__________g/cm3。

【答案】(1)3(2)3d84s2(3)sp2和sp25NA
(4)单个氢键的键能是(HF)n>冰>(NH3)n,而平均每个分子含氢键数:冰中2个,(HF)n 和(NH3)n只有1个,气化要克服的氢键的总键能是冰>(HF)n>(NH3) n (5)4 12 ![]()
![]()
【解析】
试题分析:(1)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于相邻元素,根据电离能的变化规律,半充满的N原子和全充满的Be原子第一电离能要比同周期原子序数大的原子高,故第一电离能介于B、N之间的第二周期元素有Be、C、O三种元素;
(2)元素位于第四周期VIII族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,C原子的电子排布为1s22s22p2,未成对电子数为2,则该元素为Ni,其基态原子的价层电子排布式为3d84s2;
(3)在CH2=C=O中,一个碳原子的价层电子对数为![]() =3,另一个碳原子的价层电子对数为
=3,另一个碳原子的价层电子对数为![]() =2,所以碳原子的杂化轨道类型有sp2和sp;单键全是σ键、双键有一个σ键,1mol(C2H5O)3P=O分子中含有的σ键的数目为25NA;
=2,所以碳原子的杂化轨道类型有sp2和sp;单键全是σ键、双键有一个σ键,1mol(C2H5O)3P=O分子中含有的σ键的数目为25NA;
(4)单个氢键的键能是(HF)n>冰>(NH3)n,而平均每个分子含氢键数:冰中2个,(HF)n和(NH3)n只有1个,气化要克服的氢键的总键能是冰>(HF)n>(NH3)n;
(5)碳化硅晶胞结构中每个碳原子周围与其距离最近的硅原子有4个,与碳原子等距离最近的碳原子有12个。已知碳化硅晶胞边长为apm,则晶胞图中1号硅原子和2号碳原子之间的距离为![]() pm;根据题图知,每个碳原子周围有4个硅原子与其距离最近且相等;该晶胞中含有的碳原子个数为个硅原子与其距离最近且相等,该晶胞中含有的碳原子个数为8×18+6×12=4,硅原子个数为4 ,则根据公式
pm;根据题图知,每个碳原子周围有4个硅原子与其距离最近且相等;该晶胞中含有的碳原子个数为个硅原子与其距离最近且相等,该晶胞中含有的碳原子个数为8×18+6×12=4,硅原子个数为4 ,则根据公式 ![]() ×ρ × NA=4×40g·mol- 1得ρ=
×ρ × NA=4×40g·mol- 1得ρ=![]() =
=![]() 。
。