题目内容
1.有15g A 物质与10.5g B物质恰好完全反应,生成7.2g C物质、1.8gD物质和0.3molE物质.则E的摩尔质量是( )| A. | 111g•mol-1 | B. | 100g•mol-1 | C. | 27.5g•mol-1 | D. | 55g•mol-1 |
分析 根据质量守恒定律计算0.3molE的质量,再根据M=$\frac{m}{n}$计算E的摩尔质量.
解答 解:由质量守恒定律可知,反应前后的物质的质量和相等,则E的质量为:15g+10.5g-7.2g-1.8g=16.5g,E的物质的量为0.3mol,则E的摩尔质量为$\frac{16.5g}{0.3mol}$=55g/mol,故选:D.
点评 本题考查化学方程式计算、摩尔质量的计算,关键是利用质量守恒定律计算E的质量,注意对基础知识的理解掌握.

练习册系列答案
相关题目
11.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下22.4LNO2中分子数约为NA个 | |
| B. | 常温下,18g${\;}_{\;}^{18}$O2中含有个NA氧原子 | |
| C. | 31g白磷中含的共价键数为3NA | |
| D. | 25℃时pH=13的NaOH溶液中含有0.1NAOH- |
12.某同学身体不适,出现吐酸水,恶心,胃痛等症状,若你是医生,应该建议他服用下列哪种药品( )
| A. | 阿司匹林 | B. | 阿莫西林 | C. | 感冒清 | D. | 胃得乐 |
16.如图是利用废铜屑(含杂质)制备胆矾(硫酸铜晶体)的过程

已知:
请回答:
(1)下列物质中最适宜做氧化剂X的是B(填字母).
A.NaClO B.H2O2 C.KMnO4
(2)加入试剂①是为了调节pH,试剂①可以选择CuO或CuCO3或Cu(OH)2(填化学式).
(3)操作①的名称是蒸发结晶.
(4)沉淀D加入盐酸可以得到FeCl3溶液,关于FeCl3溶液的性质中说法不正确的是C.
A.将FeCl3饱和溶液逐滴加入沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔效应
B.向FeCl3溶液滴加NaOH溶液,出现红褐色沉淀
C.将FeCl3溶液滴加NaOH溶液,将沉淀干燥灼烧,得到Fe(OH)3固体
D.向FeCl3溶液中滴加KSCN溶液,溶液变为红色
(5)沉淀D加入盐酸和铁粉,可以制得FeCl2溶液,实验室保存FeCl2溶液,需加入过量的铁粉防止FeCl2溶液变质,其原因是Fe+2Fe3+=3Fe2+(用离子方程式表示).

已知:
| 溶液中被沉淀的离子 | Fe3+ | Fe2+ | Cu2+ |
| 完全生成氢氧化物的沉淀时,溶液的pH | ≥3.7 | ≥6.4 | ≥4.4 |
(1)下列物质中最适宜做氧化剂X的是B(填字母).
A.NaClO B.H2O2 C.KMnO4
(2)加入试剂①是为了调节pH,试剂①可以选择CuO或CuCO3或Cu(OH)2(填化学式).
(3)操作①的名称是蒸发结晶.
(4)沉淀D加入盐酸可以得到FeCl3溶液,关于FeCl3溶液的性质中说法不正确的是C.
A.将FeCl3饱和溶液逐滴加入沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔效应
B.向FeCl3溶液滴加NaOH溶液,出现红褐色沉淀
C.将FeCl3溶液滴加NaOH溶液,将沉淀干燥灼烧,得到Fe(OH)3固体
D.向FeCl3溶液中滴加KSCN溶液,溶液变为红色
(5)沉淀D加入盐酸和铁粉,可以制得FeCl2溶液,实验室保存FeCl2溶液,需加入过量的铁粉防止FeCl2溶液变质,其原因是Fe+2Fe3+=3Fe2+(用离子方程式表示).
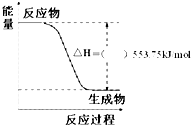
11.下列关于反应能量的说法正确的是( )
| A. | Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H=-216 kJ•mol-1,则反应物总能量>生成物总能量 | |
| B. | 相同条件下,如果1 mol氢原子所具有的能量为E1,1 mol 氢分子所具有的能量为E2,则2E1=E2 | |
| C. | 25℃、101 kPa时,2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,则H2的燃烧热为571.6 kJ•mol-1 | |
| D. | H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则1 mol NaOH的氢氧化钠固体与含0.5 mol H2SO4的稀硫酸混合后放出57.3 kJ的热量 |
 (1)北京奥运会祥云火炬将中国传统文化、奥运精神以及现代高科技融为一体.火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题:
(1)北京奥运会祥云火炬将中国传统文化、奥运精神以及现代高科技融为一体.火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题: