题目内容
在373K时,把0.5molN2O4气体通入体积为5L(恒容)的真空密闭容器中,立即出现红棕色。反应进行到2s时,NO2的浓度为0.02mol·L-1。在60s时,体系已达到平衡,此时容器内压强为反应前的1.6倍。下列说法不正确的是 ( )
A.前2s,N2O4的平均反应速率为0.005mol·L-1·s-1
B.平衡时,N2O4的转化率为60%
C.平衡时,体系内NO2为0.04mol·L-1
D.在2s时,体系内压强为反应前的1.1倍
【答案】
C
【解析】反应进行到2s时,NO2的浓度为0.02mol·L-1,所以前2s,NO2的平均反应速率为0.01mol·L-1·s-1 。根据反应速率之比是相应的化学计量数之比可知,前2s,N2O4的平均反应速率为0.005mol·L-1·s-1 ,A正确。在2s时,容器内NO2的物质的量是0.1mol,消耗N2O40.05mol,在2s时,体系内压强为反应前的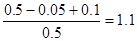 倍,D正确。
倍,D正确。
N2O4(g) 2NO2(g)
2NO2(g)
起始量(mol) 0.5 0
转化量(mol) x 2x
平衡量(mol) 0.5-x 2x
因此有 ,解得x=0.3。所以平衡时,N2O4的转化率为
,解得x=0.3。所以平衡时,N2O4的转化率为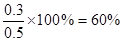 。平衡时体系内NO2为0.6mol,其浓度是0.12 mol·L-1。所以答案是C。
。平衡时体系内NO2为0.6mol,其浓度是0.12 mol·L-1。所以答案是C。

练习册系列答案
相关题目