题目内容
14.1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度是2.18克/厘米3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.在实验中可以用如图所示装置制备1,2-二溴乙烷.其中分液漏斗和仪器a中装有乙醇和浓硫酸的混合液,试管d中装有浓溴(表面覆盖少量水).请填写下列空白:
(1)图中a仪器的名称蒸馏烧瓶,实验中加入沸石的作用是防止瀑沸.若加热后发现未加沸石,应采取的正确方法是冷却后重新加入.
(2)仪器a中发生的是乙醇的消去反应,反应温度是170℃,且该反应要求温度迅速升高到170℃,请你写出乙醇的这个消去反应方程式:CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O.
(3)写出装置d中反应的化学方程式:CH2=CH2+Br2→CH2BrCH2Br.
(4)装置b的作用:防止倒吸,检验试验进行时试管d是否发生堵塞.
(5)e装置内NaOH溶液的作用是吸收HBr和Br2等气体,防止大气污染.
分析 制备1,2-二溴乙烷,由实验装置可知,分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,加热时发生CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O,浓硫酸在该反应中作催化剂、脱水剂、吸水性,b可防止倒吸,且可吸收乙醇,c中NaOH溶液可除去乙烯中的酸性物质,d中发生CH2=CH2+Br2→CH2BrCH2Br,由信息可知,冷水冷却后试管中无色液体为1,2-二溴乙烷,e可吸收尾气中的溴,
(1)根据装置图可知a仪器的名称,实验中加入沸石的作用是防止瀑沸,若加热后发现未加沸石,应冷却后重新加入;
(2)乙醇在浓硫酸做催化剂、脱水剂条件下发生消去反应生成乙烯,必须注意反应温度;
(3)乙烯与液溴发生加成反应生成1,2-二溴乙烷;
(4)依据当d堵塞时,气体不畅通,则在b中气体产生的压强将水压入直玻璃管中,甚至溢出玻璃管同时可以防止倒吸;
(5)反应剩余的溴化氢、溴等有毒,能够污染大气,需要进行尾气吸收,用e吸收.
解答 解:制备1,2-二溴乙烷,由实验装置可知,分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,加热时发生CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O,浓硫酸在该反应中作催化剂、脱水剂、吸水性,b可防止倒吸,且可吸收乙醇,c中NaOH溶液可除去乙烯中的酸性物质,d中发生CH2=CH2+Br2→CH2BrCH2Br,由信息可知,冷水冷却后试管中无色液体为1,2-二溴乙烷,e可吸收尾气中的溴,
(1)根据装置图可知a仪器的名称为蒸馏烧瓶,实验中加入沸石的作用是防止瀑沸,若加热后发现未加沸石,应冷却后重新加入,
故答案为:蒸馏烧瓶;防止瀑沸;冷却后重新加入;
(2)乙醇在170℃时发生消去生成乙烯,温度必须是170℃,反应方程式:CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O,
故答案为:CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O;
(3)乙烯与液溴发生加成反应生成1,2-二溴乙烷化学方程式为:CH2=CH2+Br2→CH2BrCH2Br;
故答案为:CH2=CH2+Br2→CH2BrCH2Br;
(4)b装置可作安全瓶,可以防止倒吸,同时试管d发生堵塞时,b中压强不断增大,会导致b中水面下降,玻璃管中的水柱上升,甚至溢出,所以d装置可以防止倒吸,同时检验试验进行时试管d是否发生堵塞,
故答案为:防止倒吸,检验试验进行时试管d是否发生堵塞;
(5)该反应中剩余的溴化氢及反应副产物溴单质等有毒,会污染大气,应该进行尾气吸收,所以装置e中氢氧化钠溶液的作用是吸收HBr和Br2等气体,防止大气污染,
故答案为:吸收HBr和Br2等气体,防止大气污染.
点评 本题考查了制备实验方案的设计、溴乙烷的制取方法,题目难度中等,注意掌握溴乙烷的制取原理、反应装置选择及除杂、提纯方法,培养学生分析问题、解决问题的能力.

| A. |  | B. |  | C. |  | D. |  |
 C2H5(g)?
C2H5(g)? CH=CH2(g)+H2(g)△H=akJ.mol-1.经一段时间后达到平衡.反应过程中测定的部分数据见下表:
CH=CH2(g)+H2(g)△H=akJ.mol-1.经一段时间后达到平衡.反应过程中测定的部分数据见下表:| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(乙苯)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
| n(苯乙烯)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
| A. | 反应在前20 min的平均速率为v(H2)=0.004mol•L-1•min-1 | |
| B. | 保持其他条件不变,升高温度,平衡时,c(乙苯)=0.08mol•L-1,则a<0 | |
| C. | 保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,则乙苯的转化率为50.0% | |
| D. | 相同温度下,起始时向容器中充入0.10mol乙苯、0.10mol苯乙烯和0.30molH2,达到平衡前v(正)>v(逆) |
回答下列问题:
(1)450℃时,往2L密闭容器中充人1molN2,和2.6molH2,反应过程中NH3的物质的量浓度随时间的变化情况如表所示:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/(mol•L-1) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
 ①反应开始的5min内,生成NH3的平均反应速率为0.016mol/(L.min);平衡时H2的转化率为23.1%;该反应的平衡常数为0.1.
①反应开始的5min内,生成NH3的平均反应速率为0.016mol/(L.min);平衡时H2的转化率为23.1%;该反应的平衡常数为0.1.②下列叙述中,能说明该合成氨反应已达到平衡的是BD(填字母代号)?
A.容器内的气体密度保持不变
B.容器内的气体压强保持不变
C.容器内N2、H2、NH3物质的量浓度之比为1:3:2
D.单位时间内消耗a molN2,同时生成3amolH2
③若再向平衡体系中充入l mol N2、2.5molH2、0.5mol NH3,平衡将正向移动(填“正向移动”、“逆向移动”或“不移动”).
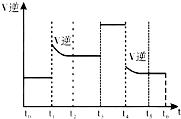
(2)由图表示反应速率与反应过程的关系,当反应达到平衡后不断改变条件(不改变N2、H2、NH3的量,每次只改变一种条件),其中t1时刻改变的条件是升高温度,表示平衡混合物中NH3的含量最高的一段时间是t0~t1段
(3)一种合成氨的新方法为:在常压下,把氢气和用氦气稀释的氮气分别通入570℃的电解池,让氢离子通过的多孔陶瓷固体作电解质,氢气和氮气在电极上合成氨,氢气转化率达到78%,该电解池阴极的电极反应式为N2+6H++6e-═2NH3.
(4)25℃时,pH=a的氨水与pH=b)的盐酸等体积混合,恰好完全反应,则该温度下原氨水电离的百分数可表示为A.
A.10(a+b-12)% B.10(a+b-14)% C.10(12-a-b)% D.10(14-a-b)%
| A. | NaAlO2溶液中:Cl-、HCO3-、K+、Ba2+ | |
| B. | FeCl3溶液中:K+、NH4+、Br-、SCN- | |
| C. | $\frac{c{(H}^{+})}{c(O{H}^{-})}$=1012的溶液中:NH4+、NO3-、K+、Cl- | |
| D. | KMnO4的溶液中:H+、SO42-、CH3CH2OH |
| 元素编号 | 元素特征信息 |
| A | 单质是密度最小的气体 |
| M | 其单质为生命活动不可缺少的气体 |
| X | 短周期中原子半径最大的元素 |
| Y | 地壳中含量最高的金属元素 |
| Z | 最外层电子数是最内层电子数的3倍 |
| E | 单质为黄绿色气体 |
(2)Y E3的水溶液显酸性,用离子方程式解释原因Al3++3H2O?Al(OH)3+3H+;Z的低价氧化物和E单质同时通入水中发生反应的离子方程式为SO2+Cl2+2H2O=4H++SO42-+2Cl-.
(3)请用“>”、“=”或“<”对物质性质进行比较
| 沸点 | 气态氢化物稳定性 | 最高价氧化物 对应水化物的碱性 | 得电子能力 |
| A2M>A2Z | Z< E | X> Y | 16M= 18M |
(5)E的最高价氧化物为无色液体,0.25mol该物质与一定量水混合得到一种稀溶液,并放出Q kJ的热量.写出该反应的热化学方程式Cl2O7(l)+H2O(l)=2HClO4(aq)△H=-4QkJ/mol.

 生物质能是一种洁净,可再生的能源.生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一.
生物质能是一种洁净,可再生的能源.生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一.