题目内容
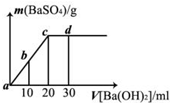 常温下,向0.1mol?L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验时不同阶段的溶液,下列有关说法中正确的是
常温下,向0.1mol?L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验时不同阶段的溶液,下列有关说法中正确的是
- A.溶液的导电能力:a<b<d<c
- B.溶液的pH:a<b<c<d
- C.a溶液和b溶液呈碱性
- D.d处沉淀的量比c处的大
B
分析:硫酸溶液加入氯化钡产物是硫酸钡与水,所以随着氢氧化钡的滴加溶液中的离子不断变少,溶液的导电能力减弱、酸性减弱,至恰好反应到c点,此时沉淀量达最大,溶液中基本无离子存在,导电能力最差,再滴加氢氧化钡溶液,溶液的碱性增强,溶液中的离子浓度增加,溶液导电能力增强.
解答:A、从a到c的过程中随着反应的进行溶液中离子浓度不断变小导电性也不断变弱,到c点两物质恰好反应,继续加入氢氧化钡溶液的导电性又会不断增强,故A错误;
B、从a到c酸不断消耗,酸性不断减弱PH不断变大,直到硫酸恰好反应,c点PH=7,再到d点溶液显碱性PH大于7,故B正确;
C、a、b两点硫酸没有被完全中和掉,故溶液显酸性,故C错误;
D、c点是硫酸与氢氧化钡恰好反应,沉淀量达最大,d点时,过量的氢氧化钡不反应,c、d两处沉淀的质量相等,故D错误;
故选B.
点评:本题是一道化学反应与图象的结合题,解题的关键是把化学反应与图象的情况结合起来,是一道训练学生分析问题能力的好题,注意A选项中可以计算b、d两处的离子浓度确定导电能力强弱.
分析:硫酸溶液加入氯化钡产物是硫酸钡与水,所以随着氢氧化钡的滴加溶液中的离子不断变少,溶液的导电能力减弱、酸性减弱,至恰好反应到c点,此时沉淀量达最大,溶液中基本无离子存在,导电能力最差,再滴加氢氧化钡溶液,溶液的碱性增强,溶液中的离子浓度增加,溶液导电能力增强.
解答:A、从a到c的过程中随着反应的进行溶液中离子浓度不断变小导电性也不断变弱,到c点两物质恰好反应,继续加入氢氧化钡溶液的导电性又会不断增强,故A错误;
B、从a到c酸不断消耗,酸性不断减弱PH不断变大,直到硫酸恰好反应,c点PH=7,再到d点溶液显碱性PH大于7,故B正确;
C、a、b两点硫酸没有被完全中和掉,故溶液显酸性,故C错误;
D、c点是硫酸与氢氧化钡恰好反应,沉淀量达最大,d点时,过量的氢氧化钡不反应,c、d两处沉淀的质量相等,故D错误;
故选B.
点评:本题是一道化学反应与图象的结合题,解题的关键是把化学反应与图象的情况结合起来,是一道训练学生分析问题能力的好题,注意A选项中可以计算b、d两处的离子浓度确定导电能力强弱.

练习册系列答案
相关题目
某氮肥厂氨氮废水中的氮元素多以NH4+ 和NH3?H2O的形式存在,经先期处理得到含HNO3的废水.一定条件下,向处理后的废水中加入CH3OH,将HNO3还原为N2.若该反应消耗32gCH3OH 转移6mol 电子,则下列说法正确的是( )
| A、硝酸分子中所有原子均达8电子结构 | B、参加反应的还原剂与氧化剂的物质的量之比为5:6 | C、常温下,向0.1mol/LNH3?H2O中加水稀释,则c(NH4+)/c(NH3?H2O) 将减小 | D、NH3分子与CO32-离子的空间构型相同 |
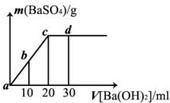 常温下,向0.1mol?L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验时不同阶段的溶液,下列有关说法中正确的是( )
常温下,向0.1mol?L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验时不同阶段的溶液,下列有关说法中正确的是( )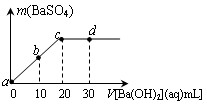 常温下,向0.1mol/L的H2SO4溶液中逐滴加入0.1mol/L的Ba(OH)2溶液,生成沉淀的质量与加入Ba(OH)2溶液的体积关系如图所示,下列说法中正确的( )
常温下,向0.1mol/L的H2SO4溶液中逐滴加入0.1mol/L的Ba(OH)2溶液,生成沉淀的质量与加入Ba(OH)2溶液的体积关系如图所示,下列说法中正确的( )