题目内容
6.常温下,下列说法正确的是( )| A. | 在(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 将pH=1的醋酸和pH=13的NaOH溶液等体积混合后的溶液c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| C. | 等体积等物质的量浓度的NaCl和CH3COONa两种溶液中离子总数:前者小于后者 | |
| D. | 等体积等物质的量浓度的HCl溶液和CH3COONa溶液混合后:c(CH3COOH)+c(CH3COO-)═c(Na+) |
分析 A.铵根离子的水解程度较小,则溶液中铵根离子浓度最大,即:c(NH4+)>c(SO42-);
B.醋酸为弱酸,则混合液中醋酸过量,溶液显示酸性,则c(H+)>c(OH-),根据电荷守恒可知c(CH3COO-)>c(Na+);
C.CH3COONa为强碱弱酸盐,水解碱性,NaCl为中性溶液,结合电荷守恒进行判断;
D.根据混合液中的物料守恒判断.
解答 解:A.(NH4)2SO4溶液中,由于铵根离子的水解程度不大,则c(NH4+)>c(SO42-),溶液中正确的离子浓度大小为:c(NH4+)>c(SO42-)>c(H+)>c(OH-),故A错误;
B.将pH=1的醋酸和pH=13的NaOH溶液等体积混合后的溶液中,由于醋酸为弱电解质,则混合液中醋酸过量,溶液显示酸性,则c(H+)>c(OH-),根据电荷守恒可知c(CH3COO-)>c(Na+),溶液中正确的离子浓度关系为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故B错误;
C.NaCl溶液呈中性,溶液中c(H+)=1×10-7mol/L,存在c(Na+)+c(H+)=c(OH-)+c(Cl-);CH3COONa为强碱弱酸盐,水解碱性,溶液中c(H+)<1×10-7mol/L,c(Na+)+c(H+)=c(OH-)+c(CH3COO-);两溶液中总电荷浓度为2c(Na+)+2c(H+),则NaCl溶液中总电荷浓度大于醋酸钠溶液,所以前者离子总数大于后者,故C错误;
D.等体积等物质的量浓度的HCl溶液和CH3COONa溶液混合后,反应生成醋酸和氯化钠,根据物料守恒可得:c(CH3COOH)+c(CH3COO-)=c(Na+),故D正确;
故选D.
点评 本题考查了离子浓度大小比较,题目难度中等,明确电荷守恒、物料守恒、盐的水解原理的应用方法为解答关键,B为易错点,注意醋酸为弱酸,混合液呈酸性,试题侧重考查学生的分析、理解能力.

| 选项 | 甲 | 乙、丙、丁 |
| ① | 常见干燥剂 | 浓硫酸、石灰石、碱石灰 |
| ② | 常见合金 | 不锈钢、青铜、生铁 |
| ③ | 基本营养物质 | 蛋白质、维生素、糖类 |
| ④ | 腐蚀品 | 浓硫酸、烧碱、硝酸 |
| ⑤ | 碱性氧化物 | 过氧化钠、氧化镁、氧化铁 |
| ⑥ | 弱电解质 | 醋酸、一水合氨、水 |
| A. | ①②③ | B. | ④⑤⑥ | C. | ②④⑥ | D. | ①⑤⑥ |
| A. | 推广使用聚二氧化碳可降解塑料,能减少白色污染 | |
| B. | 通常所说的三大有机合成材料是指塑料、合成纤维、合成橡胶 | |
| C. | 实验“煤改气”“煤改电”等清洁燃料改造工程,有利于保护环境 | |
| D. | 夏天雷雨过后感觉到空气清新是因为空气中产生了少量的二氧化氮 |
| A. | 防止“地沟油”重上餐桌的方法之一是将其制成生物柴油,在汽油中添加20%的生物柴油可减少50%的CO2、70%的SO2的排放,空气毒性可降低90% | |
| B. | 北京市600个居住小区率先进行垃圾分类试点,以促进垃圾的综合利用 | |
| C. | 减少CO2的方法有可将CO2制成干冰用于人工降雨、用石灰水吸收CO2、将CO2制成甲醇、种植树木吸收CO2等 | |
| D. | 限制化学发展,关停化工企业,消除污染源头 |
| A. | 向硫酸铝溶液中滴加过量的氨水:Al3++4OH-═AlO2-+2H2O | |
| B. | 金属铜与浓硝酸反应:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| C. | 实验室制备氢氧化铁胶体:Fe3++3H2O═Fe(OH)3(胶体)+3H+ | |
| D. | 向苯酚钠溶液中通入少量的二氧化碳气体:2C6H5ONa+CO2+H2O═2C6H6O+Na2CO3 |
| A. | 淀粉、油脂、氨基酸都能水解,但水解产物不同 | |
| B. | SO2具有氧化性,因此可用于漂白纸浆 | |
| C. | 植物油和裂化汽油都能使溴水褪色 | |
| D. | 对“地沟油”进行分馏可以制得汽油、煤油,达到变废为宝的目的 |
 (1)一定条件下,向一带活塞的密闭容器中充入2mol SO2和1mol O2发生反应:2SO2(g)+O2(g)═2SO3(g),下列说法中,正确的是C.
(1)一定条件下,向一带活塞的密闭容器中充入2mol SO2和1mol O2发生反应:2SO2(g)+O2(g)═2SO3(g),下列说法中,正确的是C.A.若υ正(O2)=2υ逆(SO3),说明该可逆反应已达到平衡状态
B.保持温度和容器体积不变,充入2mol N2,化学反应速率加快
C.平衡后移动活塞压缩气体,达到新平衡时SO2、O2的百分含量减小,SO3的百分含量增大
D.达平衡后,保持温度和容器体积不变,再充入2mol SO2,化学平衡向右移动,SO2的转化率增大.
(2)尾气SO2用NaOH溶液吸收后会生成Na2SO3.,实验测定常温下0.1mol/L Na2SO3溶液的pH为8,该溶液中由水电离出的氢氧根离子的浓度为10-6.
(3)煤炭中的硫主要以黄铁矿形式存在,用氢气脱除黄铁矿中硫的相关反应(见表),其相关反应的平衡常数的对数值与温度的关系如下.
| 相关反应 | 反应热 | 平衡常数K |
| FeS2(s)+H2(g)?FeS(s)+H2S(g) | △H1 | K1 |
| $\frac{1}{2}$FeS2(s)+H2(g)?$\frac{1}{2}$Fe(s)+H2S(g) | △H2 | K2 |
| FeS(s)+H2(g)?Fe(s)+H2S(g) | △H3 | K3 |
②提高硫的脱除率可采取的措施有升高温度(举1例).
③1000K时,平衡常数的对数lgK1=lgK2-lgK3(用lgK2和lgK3来表示).

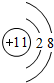 ,甲的化学式Na2S2O4
,甲的化学式Na2S2O4