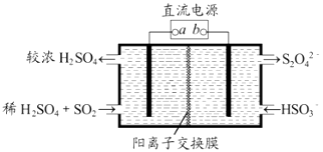
题目内容
【题目】A、B、C、D、E、X是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去)。 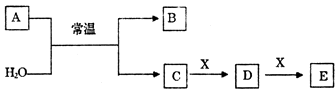
(1)若A为常见的金属单质,焰色反应呈黄色,X能使品红溶液褪色,写出C和E反应的离子方程式: .
(2)若A为短周期元素组成的单质,该元素的最高价氧化物的水化物酸性最强,则:
①组成单质A的元素在周期表中的位置为 .
②X可能为(填代号).
a.NaHCO3 b.Na2CO3 c.Na2SO3 d.Al(OH)3
(3)若A为淡黄色粉末,回答下列问题:
①1molA与足量的H2O充分反应时转移的电子数目为 .
②A的电子式为。
③若X为一种造成温室效应的气体.则鉴别等浓度的D、E两种溶液,可选择的试剂为(填代号).
a.盐酸 b.BaCl2溶液 c.NaOH溶液 d.Ca(OH)2溶液
(4)若A为氧化物,X是Fe,溶液D中加入KSCN溶液变红.
则A与H2O反应的化学反应方程式为 . E是(填化学式)。
【答案】
(1)OH-+HSO3-=SO32-+H2O
(2)第三周期ⅦA族;bc
(3)NA;![]() ;ab
;ab
(4)3NO2+H2O=2HNO3+NO;Fe(NO3)2
【解析】(1)若A为常见的金属单质,焰色反应呈黄色,应为Na,X能使品红溶液褪色,应为SO2 , 则B为H2 , C为NaOH,D为Na2SO3 , E为NaHSO3。C和E反应的离子方程式为OH-+HSO3-=SO32-+H2O,
所以答案是:OH-+HSO3-=SO32-+H2O;
(2)若A为短周期元素组成的单质,该元素的最高价氧化物的水化物酸性最强,应为Cl2 , 则B为HClO,C为HCl。①Cl原子核外有3个电子层,最外层电子数为7,位于周期表第三周期ⅦA族,所以答案是:第三周期ⅦA族;②C为盐酸,可与NaHCO3反应生成CO2 , 但CO2与NaHCO3不反应,故a错误;与Na2CO3反应生成CO2 , CO2与Na2CO3反应可生成NaHCO3 , 故b正确;与Na2SO3反应生成SO2 , SO2与Na2SO3反应可生成NaHSO3 , 故c正确;盐酸与氢氧化铝反应生成氯化铝,氯化铝与氢氧化铝不反应,故d错误,
所以答案是:bc;
(3)若A为淡黄色粉末,应为Na2O2;①1molA与足量的H2O充分反应时过氧化钠自身发生氧化还原反应,转移的电子数目为NA , 所以答案是:NA;②A为Na2O2 , 电子式为 ![]() ,所以答案是:
,所以答案是: ![]() ;③若X为一种造成温室效应的气体,应为CO2 , 则C为NaOH,D为Na2CO3 , E为NaHCO3 , 鉴别等浓度的D、E两种溶液,可用盐酸或氯化钡溶液,
;③若X为一种造成温室效应的气体,应为CO2 , 则C为NaOH,D为Na2CO3 , E为NaHCO3 , 鉴别等浓度的D、E两种溶液,可用盐酸或氯化钡溶液,
所以答案是:ab;
(4)若A为氧化物,X是Fe,由转化关系可知C具有强氧化性,则A为NO2 , B为NO,C为HNO3。NO2与水反应的方程式为3NO2+H2O=2HNO3+NO,铁与硝酸反应生成硝酸铁,硝酸铁与铁反应生成硝酸亚铁,
所以答案是:3NO2+H2O=2HNO3+NO;Fe(NO3)2。

 名校课堂系列答案
名校课堂系列答案