题目内容
【题目】以电石渣(主要成分为Ca(OH)2和CaCO3)为原料制备KClO3的流程如下:
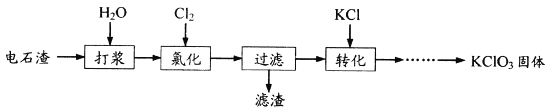
下列说法不正确的是
A. 氯化过程中主反应为:6Ca(OH)2+6Cl2= Ca(ClO3)2+5CaCl2+6H2O
B. 适当减缓通Cl2速率,充分搅拌浆料,加水使Ca(OH)2完全溶解,均有利于氯气的吸收
C. 滤液中Ca(ClO3)2与CaCl2的物质的量之比n[Ca(ClO3)2]:n[CaCl2]=1:5
D. 向滤液中加入稍过量KC1固体可将Ca(ClO3)2转化为KClO3,通过蒸发浓缩、冷却结晶的方法析出KClO3晶体
【答案】C
【解析】A、根据电石渣的成分,以及流程的目的,氯化过程中发生的反应是:6Ca(OH)2+6Cl2=Ca(ClO3)2+5CaCl2+6H2O,故A说法正确;B、充分搅拌浆料,加水能使Ca(OH)2溶解,增加反应物的接触面积,减缓通入氯气,让氯气与Ca(OH)2充分反应,故B说法正确;C、因为氯气有部分和Ca(OH)2反应生成Ca(ClO)2和CaCl2,因此滤液中Ca(ClO3)2与CaCl2的物质的量之比小于1:5,故C说法错误;D、KClO3溶解度比Ca(ClO3)2小,因此通过蒸发浓缩、冷却结晶的方法得到KClO3的晶体,故D说法正确。

练习册系列答案
相关题目