题目内容
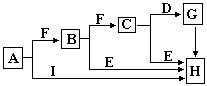
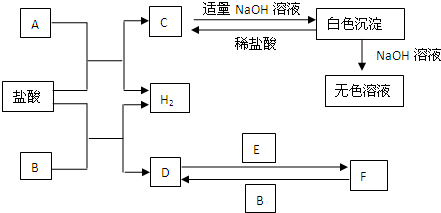
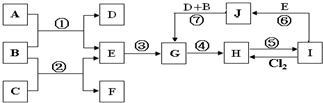
室温下,单质A、B、C分别为金属固体、黄绿色气体与无色气体,在合适条件下,它们可以按下面的流程进行反应.又知E溶液是无色的.请回答:
(1)实验室制取B的化学方程式是______.
(2)区别D和F中阳离子的方法是______.
(3)写出G→H的化学方程式______.
(4)上面流程图中属于氧化还原反应的反应数目______条.

(1)实验室制取B的化学方程式是______.
(2)区别D和F中阳离子的方法是______.
(3)写出G→H的化学方程式______.
(4)上面流程图中属于氧化还原反应的反应数目______条.
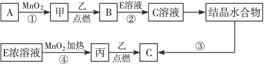
由B为黄绿色气体且为单质,可知B为Cl2;由框图可知反应生成的固体D为固体单质A与Cl2反应生成的一种氯化物;反应生成的E为Cl2与气体单质C生成的一种可溶于水的氯化物,且E溶液和固体单质A又可以重新生成气体C和F,只有当C为H2,F为一种氯化物时才能满足这一过程;而A与Cl2反应已生成了一种氯化物D,F又是一种氯化物,所以A为变价金属,应为Fe,所以A为Fe,B为Cl2,C为H2,D为FeCl3,E为HCl,F为FeCl2,G为Fe(OH)2,H为Fe(OH)3,
(1)实验室制取B为Cl2的化学方程式为:MnO2+4HCl
MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl
MnCl2+Cl2↑+2H2O;
(2)D中阳离子为Fe3+,F中阳离子为Fe2+,区别离子的方法是:溶液的颜色,三价铁离子溶液为黄色溶液,亚铁离子溶液为浅绿色溶液;或利用硫氰酸钾溶液遇到三价铁离子会生成血红色硫氰酸铁溶液,故答案为:取D、F少量溶液于试管中,分别加入KSCN溶液,溶液变血红色,证明是三价铁离子;
(3)G→H为Fe(OH)2和O2反应生成Fe(OH)3的反应,反应的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)B+F→D的反应为Cl2和FeCl2生成FeCl3的反应,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,
故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(4)依据判断出的物质和转化关系分析,元素化合价变化的为氧化还原反应,A+B=D,B+C=E,E+A=F,B+F=D都是氧化还原反应,故答案为:4;
(1)实验室制取B为Cl2的化学方程式为:MnO2+4HCl
| ||
故答案为:MnO2+4HCl
| ||
(2)D中阳离子为Fe3+,F中阳离子为Fe2+,区别离子的方法是:溶液的颜色,三价铁离子溶液为黄色溶液,亚铁离子溶液为浅绿色溶液;或利用硫氰酸钾溶液遇到三价铁离子会生成血红色硫氰酸铁溶液,故答案为:取D、F少量溶液于试管中,分别加入KSCN溶液,溶液变血红色,证明是三价铁离子;
(3)G→H为Fe(OH)2和O2反应生成Fe(OH)3的反应,反应的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)B+F→D的反应为Cl2和FeCl2生成FeCl3的反应,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,
故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(4)依据判断出的物质和转化关系分析,元素化合价变化的为氧化还原反应,A+B=D,B+C=E,E+A=F,B+F=D都是氧化还原反应,故答案为:4;

练习册系列答案
相关题目
 (2)某些元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是(填离子符号) 。
(2)某些元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是(填离子符号) 。