题目内容
【题目】在一密闭容器中通入A、B、C三种气体,保持一定温度,在t1~t4 s时测得各物质的浓度如表,则下列判断正确的是
测定时刻/s 浓度 | t1 | t2 | t3 | t4 |
c(A)/(mol·L1) | 6 | 3 | 2 | 2 |
c(B)/(mol·L1) | 5 | 3.5 | 3 | 3 |
c(C)/(mol·L1) | 1 | 2.5 | 3 | 3 |
A.在t3 s时反应已经停止
B.t3~t4 s内正、逆反应速率不相等
C.在容器中发生的反应为A(g)+B(g)![]() C(g)
C(g)
D.在t2~t3 s内A的平均反应速率为![]() mol·L1·s1
mol·L1·s1
【答案】D
【解析】A、由题给数据可知,t3 s时可逆反应达到化学平衡状态,此时v(正)=v(逆)≠0,A错误;B、t3~t4 s内,A、B、C的浓度没有发生变化,反应处于化学平衡状态,正、逆反应速率相等,B错误;C、达到化学平衡状态时,A、B、C的浓度变化量之比为4∶2∶2=2∶1∶1,故该反应的化学方程式为2A(g)+B(g)![]() C(g),C错误;D、t2~t3 s内,Δc(A)=1 mol·L1,故用A表示的该时间段的平均化学反应速率为
C(g),C错误;D、t2~t3 s内,Δc(A)=1 mol·L1,故用A表示的该时间段的平均化学反应速率为![]() mol·L1·s1,D正确。答案选D。
mol·L1·s1,D正确。答案选D。

【题目】CO、CO2是火力发电厂释放出的主要尾气,为减少对环境造成的影响,发电厂试图采用以下方法将其资源化利用,重新获得燃料或重要工业产品。
(1)CO 与Cl2在催化剂的作用下合成光气(COCl2)。某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)![]() COCl2(g) ;△H=akJ/mol 反应过程中测定的部分数据如下表:
COCl2(g) ;△H=akJ/mol 反应过程中测定的部分数据如下表:
t/min | n (CO) /mol | n(Cl2)/mol |
0 | 1.20 | 0.60 |
1 | 0.90 | |
2 | 0.80 | |
4 | 0.20 |
①反应1~2min末的平均速率v(COCl2)=________mol/(L·min)。
②在2min~4min间,vCl2正_______vCO逆 (填“>”、“=”或“<”),该温度下K=________。
③已知X、L可分别代表温度或压强,下图表示L一定时,CO的转化率随X的变化关系。
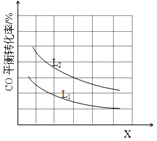
X代表的物理量是___________;a_______0 (填“>”,“=”,“<”)。
(2)在催化剂作用下NO和CO转化为无毒气体:2CO(g) +2NO(g)![]() 2CO2(g) +N2(g);△H=-748kJ·mol-1
2CO2(g) +N2(g);△H=-748kJ·mol-1
①一定条件下,单位时间内不同温度下测定的氮氧化物转化率如图1所示。温度高于710K时,随温度的升高氮氧化物转化率降低的原因可能是________________________________________________。

②已知: 测定空气中NO和CO含量常用的方法有两种:
方法1:电化学气敏传感器法。其中CO 传感器的工作原理如图2 所示,则工作电极的反应式为____________。
方法2:氧化还原滴定法。用H2O2溶液吸收尾气、将氮氧化物转化为强酸,用酸碱中和滴定法测定强酸依度。写出NO与H2O2溶液反应的离子方程式:____________。