题目内容
(9分)向Fe3O4和 Fe的固体混合物6.88g中加入50ml 2 mol·L—1H2SO4,恰好使固体完全溶解,并放出一定量气体。在所得溶液中加入KSCN溶液,溶液不变红色。
(1) 写出Fe3O4和稀H2SO4反应的化学方程式______________________________。
(2) 混合物中Fe3O4和 Fe的物质的量(写出计算过程)。
(3) 求反应中产生的气体在标准状况下的体积。(写出计算过程)。
若用足量的CO在高温下与相同质量的上述固体混合物反应,求最终能得到铁的质量。(写出计算过程)。
(1) 写出Fe3O4和稀H2SO4反应的化学方程式______________________________。
(2) 混合物中Fe3O4和 Fe的物质的量(写出计算过程)。
(3) 求反应中产生的气体在标准状况下的体积。(写出计算过程)。
若用足量的CO在高温下与相同质量的上述固体混合物反应,求最终能得到铁的质量。(写出计算过程)。
(1)Fe3O4+4H2SO4==FeSO4+Fe2(SO4)3+4H2O(1分)
(2)n(Fe3O4)="0.02" mol; n(Fe)="0.04" mol 。(每空2分)
(3)448ml(2分) (4)5.6g(2分)
(2)n(Fe3O4)="0.02" mol; n(Fe)="0.04" mol 。(每空2分)
(3)448ml(2分) (4)5.6g(2分)
(2)设Fe、Fe3O4的物质的量分别为n1,n2,
56n1+232n2="6.88g" ①
据题意,得:反应过程中,发生了以下3个反应,
Fe3O4+4H2SO4==FeSO4+Fe2(SO4)3+4H2O Fe+Fe2(SO4)3=3FeSO4 Fe+H2SO4=FeSO4+H2↑
1 4 1 1 1 1 1
n2 4n2 n2 n2 n2 (n1- n2)(n1- n2)
则:4n2+(n1- n2)=0.05L×2 mol·L—1="0.1mol" ②
联立①②,得n1="0.04mol" ,n2=0.02mol
(3)V(H2)=22.4L.mol-1×(n1- n2)= 448ml
(4) Fe3O4+4CO=高温=3Fe+ 4CO2
1 3
0.02mol 0.06mol
最终能得到铁的质量:(0.06mol+0.04mol)×56g.mol-1=5.6g
56n1+232n2="6.88g" ①
据题意,得:反应过程中,发生了以下3个反应,
Fe3O4+4H2SO4==FeSO4+Fe2(SO4)3+4H2O Fe+Fe2(SO4)3=3FeSO4 Fe+H2SO4=FeSO4+H2↑
1 4 1 1 1 1 1
n2 4n2 n2 n2 n2 (n1- n2)(n1- n2)
则:4n2+(n1- n2)=0.05L×2 mol·L—1="0.1mol" ②
联立①②,得n1="0.04mol" ,n2=0.02mol
(3)V(H2)=22.4L.mol-1×(n1- n2)= 448ml
(4) Fe3O4+4CO=高温=3Fe+ 4CO2
1 3
0.02mol 0.06mol
最终能得到铁的质量:(0.06mol+0.04mol)×56g.mol-1=5.6g

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
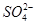 的立体构型是________,其中S原子的杂化轨道类型是_______;
的立体构型是________,其中S原子的杂化轨道类型是_______;