题目内容
(1)在饱和Na2CO3溶液中通入足量的CO2气体,会有晶体析出,此晶体是_________。析出晶体的原因有:①___________,②_____________,③_________________。(2)向Na2CO3溶液中逐滴滴入稀盐酸,溶液中的![]() 浓度的变化情况是_____________。
浓度的变化情况是_____________。
A.逐渐增大 B.逐渐变小
C.先逐渐增大而后减小 D.先逐渐减小后变大
试用离子方程式和简要文字说明理由______________________________________________。
解析:(1)由Na2CO3+H2O+CO2====2NaHCO3可知,此反应消耗水,且Na2CO3转化为NaHCO3后溶质质量增加,又因NaHCO3溶解度较小,所以会有晶体析出。
(2)向饱和Na2CO3溶液中逐滴滴入稀盐酸时,![]() 与H+先结合生成
与H+先结合生成![]() ,
,![]() 浓度增大;继续加盐酸时,
浓度增大;继续加盐酸时,![]() 与多余的H+结合产生CO2放出,
与多余的H+结合产生CO2放出,![]() 浓度逐渐减小。
浓度逐渐减小。
答案:(1)NaHCO3 ①NaHCO3溶解度较小 ②反应时消耗了一部分水③生成NaHCO3后溶质质量变大
(2)C 因![]() +H+====
+H+====![]() ,开始时
,开始时![]() 浓度增大,继续加盐酸时
浓度增大,继续加盐酸时![]() +H+====CO2↑+H2O,
+H+====CO2↑+H2O,![]() 浓度逐渐减小
浓度逐渐减小

练习册系列答案
相关题目
 实验室用如图所示的装置制取乙酸乙酯.
实验室用如图所示的装置制取乙酸乙酯.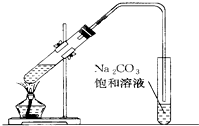 如图是实验室制乙酸乙酯的装置.
如图是实验室制乙酸乙酯的装置.