题目内容
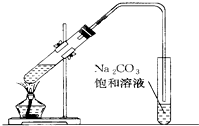 如图是实验室制乙酸乙酯的装置.
如图是实验室制乙酸乙酯的装置.(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合溶液的方法是将
(2)装置中通蒸气的导管要插在饱和Na2CO3溶液的液面上方.不能插入溶液中,目的是防止Na2CO3溶液的倒吸.造成倒吸的原因是
(3)浓硫酸的作用是①
(4)饱和Na2CO3溶液的作用是
(5)实验生成的乙酸乙酯,其密度比水
(6)实验室制取乙酸乙酯的反应原理是
分析:(1)加入药品时,为防止酸液飞溅,应先加入乙醇再加入浓硫酸和乙酸;
(2)根据粗产品乙酸乙酯、乙酸和乙醇的混合物中各自的性质,进行解答;
(3)乙酸与乙醇需浓硫酸作催化剂,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动;
(4)用饱和碳酸钠溶液吸收乙酸乙酯,乙醇溶解,碳酸钠与乙酸反应除去乙酸、同时降低乙酸乙酯的溶解度;
(5)根据实验操作和实验现象进行解答;
(6)酯化反应的本质为酸脱羟基,醇脱氢.
(2)根据粗产品乙酸乙酯、乙酸和乙醇的混合物中各自的性质,进行解答;
(3)乙酸与乙醇需浓硫酸作催化剂,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动;
(4)用饱和碳酸钠溶液吸收乙酸乙酯,乙醇溶解,碳酸钠与乙酸反应除去乙酸、同时降低乙酸乙酯的溶解度;
(5)根据实验操作和实验现象进行解答;
(6)酯化反应的本质为酸脱羟基,醇脱氢.
解答:解:(1)浓硫酸溶于水放出大量的热,加入药品时,为防止酸液飞溅,应先加入乙醇再加入浓硫酸和乙酸,如先加浓硫酸会出现酸液飞溅的可能现象,
故答案为:乙醇先加入试管中,后加入浓硫酸,最后加乙酸;
(2)乙酸乙酯中混有乙醇和乙酸,二者易溶于水而产生倒吸,故答案为:乙酸和乙醇都易溶于Na2CO3溶液;
(3)乙酸与乙醇需浓硫酸作催化剂,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动.故浓硫酸的作用为催化剂,吸水剂,
故答案为:作催化剂;吸收生成的水,以利于平衡向酯化方向移动;
(4)制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯,目的是除去乙醇和乙酸、降低乙酸乙酯的溶解度,便于分层,
故答案为:除去酯中混有的酸和醇;降低酯的溶解度利于分层;
(5)在碳酸钠溶液层上方有无色油状液体出现,闻到香味,说明实验中生成的乙酸乙酯,其密度比水小,故答案为:小;果香;
(6)实验中用乙醇与乙酸作用,酯化反应的本质为酸脱羟基,醇脱氢,该反应生成乙酸乙酯和水,反应方程式为:CH3COOH+CH3CH2OH
CH3COOC2H5+H2O,
故答案为:CH3COOH+CH3CH2OH
CH3COOC2H5+H2O.
故答案为:乙醇先加入试管中,后加入浓硫酸,最后加乙酸;
(2)乙酸乙酯中混有乙醇和乙酸,二者易溶于水而产生倒吸,故答案为:乙酸和乙醇都易溶于Na2CO3溶液;
(3)乙酸与乙醇需浓硫酸作催化剂,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动.故浓硫酸的作用为催化剂,吸水剂,
故答案为:作催化剂;吸收生成的水,以利于平衡向酯化方向移动;
(4)制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯,目的是除去乙醇和乙酸、降低乙酸乙酯的溶解度,便于分层,
故答案为:除去酯中混有的酸和醇;降低酯的溶解度利于分层;
(5)在碳酸钠溶液层上方有无色油状液体出现,闻到香味,说明实验中生成的乙酸乙酯,其密度比水小,故答案为:小;果香;
(6)实验中用乙醇与乙酸作用,酯化反应的本质为酸脱羟基,醇脱氢,该反应生成乙酸乙酯和水,反应方程式为:CH3COOH+CH3CH2OH
| 浓硫酸 |
| △ |
故答案为:CH3COOH+CH3CH2OH
| 浓硫酸 |
| △ |
点评:本题考查了乙酸乙酯的制备,注意掌握乙酸乙酯的制备原理和实验方法,把握乙酸乙酯与乙酸、乙醇性质的区别,题目难度不大.

练习册系列答案
相关题目
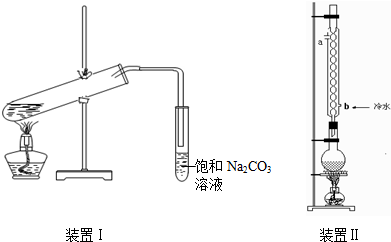 如图装置Ⅰ是实验室制乙酸乙酯的常用装置:
如图装置Ⅰ是实验室制乙酸乙酯的常用装置:(装置1大试管口是否要加橡胶塞)
实验中所用的某些试剂及产物的相关数据如下:
| 物 质 | 2,4,6 熔点/℃ |
沸点/℃ | 密度/g?cm-3 |
| 乙 醇 | -114 | 78 | 0.789 |
| 乙 酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.900 |
| 98%H2SO4 | 10 | 338 | 1.84 |
(1)如果用CH3CO18OH与CH3CH2OH反应,写出该反应的化学方程式(在反应物和生成物中标出18O的位置)
(2)要从装置Ⅰ中右侧小试管中分离出乙酸乙酯,应进行的操作是:撤出小试管,将混合液倒入
(3)采用装置Ⅱ可提高乙酸乙酯的产率,结合表格中的数据,说明该装置可提高乙酸乙酯产率的原因:

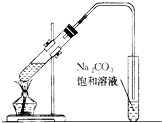 如图是实验室制乙酸乙酯的装置.
如图是实验室制乙酸乙酯的装置.