题目内容
下列有关说法错误的是( )
分析:A.判断中心原子形成的δ键和孤电子对数,可确定杂化类型;
B.根据最外层电子数判断;
C.根据同周期元素的性质递变规律判断;
D.同主族元素从上到下第一电离能逐渐减小.
B.根据最外层电子数判断;
C.根据同周期元素的性质递变规律判断;
D.同主族元素从上到下第一电离能逐渐减小.
解答:解:A.H2O中含有2个δ键,有2个孤电子对,为SP3杂化,NH3中含有3个δ键,有1个孤电子对,为SP3杂化,CH4中含有4个δ键,无孤电子对,为SP3杂化,故A正确;
B.P、S、Cl元素的原子最外层电子数依次为5、6、7,最高化合价依次升高,故B正确;
C.N、O、F位于同一周期,同周期元素从左到右元素的电负性依次增大,故C正确;
D.Na、K、Rb位于同一主族,同主族元素从上到下第一电离能逐渐减小,故D错误.
故选D.
B.P、S、Cl元素的原子最外层电子数依次为5、6、7,最高化合价依次升高,故B正确;
C.N、O、F位于同一周期,同周期元素从左到右元素的电负性依次增大,故C正确;
D.Na、K、Rb位于同一主族,同主族元素从上到下第一电离能逐渐减小,故D错误.
故选D.
点评:本题考查较为综合,涉及杂化轨道以及元素周期律的递变规律的判断,注意把握杂化轨道的判断方法和元素周期律的递变规律,题目难度不大.

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
化学与生活、环境密切相关,下列有关说法错误的是( )
| A、人们用明矾对水进行消毒、杀菌 | B、CO2、CH4等均是造成温室效应的气体 | C、食用一定量的油脂能促进人体对某些维生素的吸收 | D、自行车钢架生锈主要是电化学腐蚀所致 |
下列有关说法错误的是( )
| A、李比希法是最早用于测定有机化合物中碳、氢元素质量分数的方法 | B、元素分析仪可以确定有机物的分子结构 | C、“基团理论”对有机化学的发展起到了巨大的推动作用 | D、1H核磁共振谱是测定有机物结构的常用方法 |
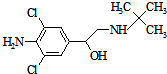 央视3.15节目抛出一枚食品安全重弹,曝光了某品牌食品在生产中使用“瘦肉精”猪肉.瘦肉精(Clenbuterol)是一种廉价药品,学名盐酸克伦特罗,它对于减少脂肪增加瘦肉作用非常好,但它有很危险的副作用,轻则导致心律不整,重则导致心脏病.盐酸克伦特罗的结构简式如图.下列有关说法错误的是( )
央视3.15节目抛出一枚食品安全重弹,曝光了某品牌食品在生产中使用“瘦肉精”猪肉.瘦肉精(Clenbuterol)是一种廉价药品,学名盐酸克伦特罗,它对于减少脂肪增加瘦肉作用非常好,但它有很危险的副作用,轻则导致心律不整,重则导致心脏病.盐酸克伦特罗的结构简式如图.下列有关说法错误的是( )