��Ŀ����
����Ŀ�����������һ�ֿɳ���أ������ͼ������ʾ������������Zn������������Zn(OH)2������������K2FeO4(������)����ԭ������Fe(OH)3���������Һ��KOHˮ��Һ�������й�˵����ȷ����
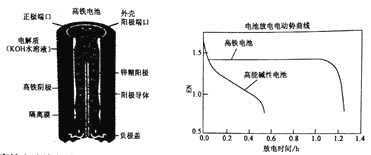
A. ������طŵ�ʱ������ӦΪ��Zn+2OH--2e-=Zn(OH)2
B. ������س��ʱ������ӦΪFe(OH)3+5OH--3e-=FeO42-+4H2O
C. ������طŵ�ʱ���ܷ�ӦΪ��2FeO42-+8H2O+3Zn=2 Fe(OH)3+3 Zn(OH)2+4OH-
D. ���ܼ��Ե�رȸ�����ع�����ѹ���ȶ�
���𰸡�C
��������A���ŵ�ʱ����������ԭ��Ӧ��Ӧ��FeO42-�õ��ӣ���A����B�����ʱ����������ԭ��Ӧ����B����C. ������طŵ�ʱ���ܷ�ӦΪ2FeO42-+8H2O+3Zn=2 Fe(OH)3+3 Zn(OH)2+4OH-����C��ȷ��D��������رȸ��ܼ��Ե�ع�����ѹ���ȶ�����D����ΪC��

����Ŀ�����������л��е��������ʣ���ѡ�õ��Լ�������������ȷ���ǣ� ��
���� | ���ʣ������� | �Լ��Ͳ������� | |
A | O2 | H2O�������� | ͨ��ŨH2SO4 |
B | CO2 | CO | ��ȼ |
C | KCl���� | KClO3 | ����MnO2������ |
D | KNO3��Һ | Ba��NO3��2��Һ | ����������Na2SO4��Һ������ |
A.A
B.B
C.C
D.D
����Ŀ���������ʵ��׳ƺ�������������ȷ����
ѡ�� | ��ѧʽ | �׳� | ��� |
A | C2H6O | �ƾ� | �л��� |
B | NaOH | ������ | �� |
C | Na2CO3 | �ռ� | �� |
D | NaHCO3 | С�մ� | �� |
A. AB. BC. CD. D

