题目内容
已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l)(g);DH=-Q1②2H2(g)+O2(g)=2H2O(g)。DH=-Q2
③
常温下取体积比为4∶1的甲烷和氢气混合气体11.2L(标准状况),经完全燃烧后恢复
至室温,则放出的热量为( )
A.0.4mol Q1+0.05mol Q3 B.0.4mol Q1+0.05mol Q2
C.0.4mol Q1+0.1 mol Q3 D.0.4mol Q1+0.2mol Q2
提示:
| 由于题设条件下氢气的燃烧产物是液态水,因此应该用③式反应提供的反应热数据,而不应用②式反应提供的数据。由题意不难确定,混合气体中n(CH4)=0.4mol,n(H2)=0.1mol。由反应①、③可知,1mol
CH4完全燃烧时放出的热量为Q1,2mol
H2完全燃烧生成液态水时放出的热量为Q3,因此,11.2L混合气体在题设条件下燃烧放出的热量为0.4mol
Q1+0.05mol
Q3。
|

氮氧化物是大气污染物之一,消除氮氧化物的方法有多种。
(1)利用甲烷催化还原氮氧化物。已知:
①CH4 (g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)?? △H =-574 kJ/mol
②CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g)? △H =-1160 kJ/mol
则CH4 将NO2 还原为N2 的热化学方程式为:??????????? ???????????? 。
 (2)利用NH3催化还原氮氧化物(SCR技术)。该技术是目前应用最广泛的烟气氮氧化物脱除技术。 反应的化学方程式为:
(2)利用NH3催化还原氮氧化物(SCR技术)。该技术是目前应用最广泛的烟气氮氧化物脱除技术。 反应的化学方程式为: 为提高氮氧化物的转化率可采取的措施是???????? ????????????????????????? (写出1条即可)。
为提高氮氧化物的转化率可采取的措施是???????? ????????????????????????? (写出1条即可)。
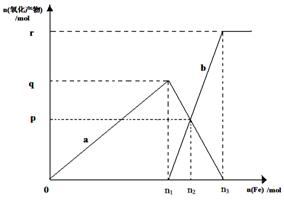
(3)利用ClO2 氧化氮氧化物。其转化流程如下:? NO NO2
NO2 N2。已知反应Ⅰ的化学方程式为2NO+ ClO2 + H2O =NO2 + HNO3 + HCl,则反应Ⅱ的化学方程式是???????? ????? ;若生成11.2 L N2(标准状况),则消耗ClO2 ??????? g 。
N2。已知反应Ⅰ的化学方程式为2NO+ ClO2 + H2O =NO2 + HNO3 + HCl,则反应Ⅱ的化学方程式是???????? ????? ;若生成11.2 L N2(标准状况),则消耗ClO2 ??????? g 。
(4)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g) N2 (g)+CO2 (g)△H.某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2 (g)+CO2 (g)△H.某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度/mol?L-1/ 时间/min | NO | N2 | CO2 |
0 | 0.100 | 0 | 0 |
10 | 0.058 | 0.021 | 0.021 |
20 | 0.040 | 0.030 | 0.030 |
30 | 0.040 | 0.030 | 0.030 |
40 | 0.032 | 0.034 | 0.017 |
50 | 0.032 | 0.034 | 0.017 |
①T1℃时,该反应的平衡常数K= ????????? (保留两位小数).②30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是 ????????????? .③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的△H ?? 0(填“>”、“=”或“<”).
 N2(g)+2CO2(g)
△H<0。
N2(g)+2CO2(g)
△H<0。 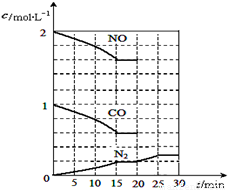

 Ni(OH)2+M
Ni(OH)2+M