题目内容
(2013?广州模拟)大型钢铁企业酸洗钢材时产生的废液主要成分为Fe2+、H+、Cl-,可用下述方法处理该废液,回收盐酸,制备氧化铁涂料.
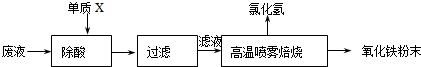
(1)单质X的化学式是
(2)氯化亚铁溶液经高温喷雾焙烧时转化为氯化氢气体和氧化铁粉末.有关的化学方程式为:
(3)某种铁红涂料的成分中,除含有Fe2O3外,还添加有CuO或FeO中的一种.请设计实验探究该铁红涂料中添加的物质.
①提出合理假设,假设1:添加了CuO.假设2:添加了FeO.
②基于假设
(4)用水吸收“高温喷雾焙烧”时产生的氯化氢气体可得到盐酸.请计算:用1000g水需吸收标准状况下多少升氯化氢气体可得到36.5%的浓盐酸?(写出计算过程,结果可用数学表达式表示,不必化简).

(1)单质X的化学式是
Fe
Fe
.(2)氯化亚铁溶液经高温喷雾焙烧时转化为氯化氢气体和氧化铁粉末.有关的化学方程式为:
FeCl2+2H2O?Fe(OH)2+2HCl,4Fe(OH)2+O2+2H2O=4Fe(OH)3,2Fe(OH)3
Fe2O3+3H2O
| ||
FeCl2+2H2O?Fe(OH)2+2HCl,4Fe(OH)2+O2+2H2O=4Fe(OH)3,2Fe(OH)3
Fe2O3+3H2O
.
| ||
(3)某种铁红涂料的成分中,除含有Fe2O3外,还添加有CuO或FeO中的一种.请设计实验探究该铁红涂料中添加的物质.
①提出合理假设,假设1:添加了CuO.假设2:添加了FeO.
②基于假设
1
1
(填“1”或“2”),设计实验方案,进行实验.在答题卡上写出实验步骤、预期现象和结论.限选实验试剂:铁粉、3mol?L-1H2SO4、0.01mol?L-1酸性KMnO4溶液、10%NaOH溶液、10%H2O2、KSCN溶液| 操作步骤 | 预期现象和结论 |
| 步骤1.取少量样品于试管中, 加入足量的3mol?L-1H2SO4,充分振荡 加入足量的3mol?L-1H2SO4,充分振荡 |
样品全部溶解 样品全部溶解 |
| 步骤2. 取少许溶液于试管中,加入足量铁粉,充分振荡;再加入足量3mol?L-1H2SO4,充分振荡 取少许溶液于试管中,加入足量铁粉,充分振荡;再加入足量3mol?L-1H2SO4,充分振荡 |
试管中出现红色固体,说明试样中有CuO 试管中出现红色固体,说明试样中有CuO |
设所需的HCl体积为V,则溶质质量是:
g,溶液质量=溶质质量+溶剂质量=1000g+
g,所以
g=(1000g+
g)×36.5%,解得V=
L.
| 36.5V |
| 22.4 |
| 36.5V |
| 22.4 |
| 36.5V |
| 22.4 |
| 36.5V |
| 22.4 |
| 22400 |
| 63.5 |
设所需的HCl体积为V,则溶质质量是:
g,溶液质量=溶质质量+溶剂质量=1000g+
g,所以
g=(1000g+
g)×36.5%,解得V=
L.
.| 36.5V |
| 22.4 |
| 36.5V |
| 22.4 |
| 36.5V |
| 22.4 |
| 36.5V |
| 22.4 |
| 22400 |
| 63.5 |
分析:(1)根据目的:除去盐酸获得亚铁盐来选择合适当金属;
(2)亚铁离子在溶液中会发生水解反应生成氢氧化亚铁,接着会被氧化为氢氧化铁,氢氧化铁可以分解;
(3)氧化铜可以溶解于强酸溶液中,得到含有铜离子的盐,加入足量铁粉可以将金属铜置换出来;氧化亚铁可以和强酸反应生成亚铁盐,能使高锰酸钾褪色;
(4)根据溶质的质量分数=
×100%来计算即可.
(2)亚铁离子在溶液中会发生水解反应生成氢氧化亚铁,接着会被氧化为氢氧化铁,氢氧化铁可以分解;
(3)氧化铜可以溶解于强酸溶液中,得到含有铜离子的盐,加入足量铁粉可以将金属铜置换出来;氧化亚铁可以和强酸反应生成亚铁盐,能使高锰酸钾褪色;
(4)根据溶质的质量分数=
| 溶质质量 |
| 溶液质量 |
解答:解:(1)除去盐酸获得亚铁盐,所加的金属只能是金属铁,故答案为:Fe;
(2)氯化亚铁溶液中亚铁离子会发生水解反应生成氢氧化亚铁,即FeCl2+2H2O?Fe(OH)2+2HCl,氢氧化亚铁不稳定,会被氧化为氢氧化铁,4Fe(OH)2+O2+2H2O=4 Fe(OH)3,氢氧化铁可以分解,即2Fe(OH)3
Fe2O3+3H2O,
故答案为:FeCl2+2H2O?Fe(OH)2+2HCl,4Fe(OH)2+O2+2H2O=4 Fe(OH)3,2Fe(OH)3
Fe2O3+3H2O;
(3)氧化铜可以溶解于强酸溶液中,得到含有铜离子的盐,加入足量铁粉可以将金属铜置换出来,据此可以检验固体是氧化铜,氧化亚铁可以和强酸反应生成亚铁盐,能使高锰酸钾褪色,据此可以检验固体中含有氧化亚铁,
故答案为:
假设1
或:假设2
(4)设所需的HCl体积为V,则溶质质量是:
g,溶液质量=溶质质量+溶剂质量=1000g+
g,所以
g=(1000g+
g)×36.5%,解得V=
L,
故答案为:设所需的HCl体积为V,则溶质质量是:
g,溶液质量=溶质质量+溶剂质量=1000g+
g,所以
g=(1000g+
g)×36.5%,解得V=
L.
(2)氯化亚铁溶液中亚铁离子会发生水解反应生成氢氧化亚铁,即FeCl2+2H2O?Fe(OH)2+2HCl,氢氧化亚铁不稳定,会被氧化为氢氧化铁,4Fe(OH)2+O2+2H2O=4 Fe(OH)3,氢氧化铁可以分解,即2Fe(OH)3
| ||
故答案为:FeCl2+2H2O?Fe(OH)2+2HCl,4Fe(OH)2+O2+2H2O=4 Fe(OH)3,2Fe(OH)3
| ||
(3)氧化铜可以溶解于强酸溶液中,得到含有铜离子的盐,加入足量铁粉可以将金属铜置换出来,据此可以检验固体是氧化铜,氧化亚铁可以和强酸反应生成亚铁盐,能使高锰酸钾褪色,据此可以检验固体中含有氧化亚铁,
故答案为:
假设1
| 实验操作 | 预期现象和结论 |
| 步骤1:加入足量的3mol?L-1H2SO4,充分振荡. | 样品全部溶解 |
| 步骤2:取少许溶液于试管中,加入足量铁粉,充分振荡;再加入足量3mol?L-1H2SO4,充分振荡. | 试管中出现红色固体,说明试样中有CuO |
| 实验操作 | 预期现象和结论 |
| 步骤1:加入足量的3mol?L-1H2SO4,充分振荡. | 样品全部溶解 |
| 步骤2:取少许溶液于试管中,逐滴加入0.01 mol?L-1酸性KMnO4溶液 | 如果紫红色褪去,说明试样中有FeO; |
| 36.5V |
| 22.4 |
| 36.5V |
| 22.4 |
| 36.5V |
| 22.4 |
| 36.5V |
| 22.4 |
| 22400 |
| 63.5 |
故答案为:设所需的HCl体积为V,则溶质质量是:
| 36.5V |
| 22.4 |
| 36.5V |
| 22.4 |
| 36.5V |
| 22.4 |
| 36.5V |
| 22.4 |
| 22400 |
| 63.5 |
点评:本题是一道实验设计题,考查学生分析和解决问题的能力,综合性强,难度大.

练习册系列答案
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
相关题目
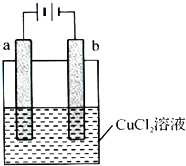 (2013?广州模拟)某小组为研究电化学原理,设计如下图装置,下列叙述中正确的是( )
(2013?广州模拟)某小组为研究电化学原理,设计如下图装置,下列叙述中正确的是( )