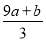题目内容
已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4 2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当 铅蓄电池中转移0.4 mol电子时铁电极的质量减少11.2 g。请回答 下列问题。
2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当 铅蓄电池中转移0.4 mol电子时铁电极的质量减少11.2 g。请回答 下列问题。
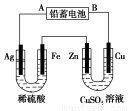
(1)A是铅蓄电池的 极,铅蓄电池正极反应式为 ,放电过程中电解液的密度 (填“减小”、“增大”或“不变”)。
(2)Ag电极的电极反应式是 ,该电极的电极产物共 g。
(3)Cu电极的电极反应式是 ,CuSO4溶液的浓度 (填“减小”、“增大”或“不变”)
(4)如图表示电解进行过程中某个量(纵坐标x)随时间的变化曲线,则x表示 。
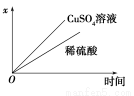
a.各U形管中产生的气体的体积
b.各U形管中阳极质量的减少量
c.各U形管中阴极质量的增加量
(1)负 PbO2+4H++SO42-+2e-=PbSO4+2H2O 减小
(2)2H++2e-=H2↑ 0.4
(3)Cu-2e-=Cu2+ 不变
(4)b
【解析】根据在电解过程中铁电极质量的减少可判断A是电源的负极,B是电源的正极,电解时Ag极作阴极,电极反应式为2H++2e-=H2↑,Fe作阳极,电极反应式为Fe-2e-=Fe2+,左侧U形管中总反应式为Fe+2H+=Fe2++H2↑。右侧U形管相当于电镀装置,Zn电极作阴极,电极反应式为Cu2++2e-=Cu,铜电极作阳极,电极反应式为Cu-2e-=Cu2+,电镀过程中CuSO4溶液的浓度保持不变,根据上述分析可得答案。

化学学科中的化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。
请回答下列问题:
 (1)工业上采取CO和H2为原料合成乙醇,其化学反应方程式为:2CO(g)+4H2(g)??
(1)工业上采取CO和H2为原料合成乙醇,其化学反应方程式为:2CO(g)+4H2(g)??
CH3CH2OH(g)+H2O(g)。请写出该反应的化学平衡常数表达式K=________。
(2)常温下,浓度均为0.1 mol·L-1的六种溶液的pH如下表:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | Na2SO4 |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 7.0 |
①上述盐溶液中的阴离子,结合质子能力最强的是________。
②根据表中数据,浓度均为0.01 mol·L-1的下列五种物质的溶液中,酸性最强的是________(填字母);将各溶液分别稀释100倍,pH变化最小的是________(填字母)。
A.HCN B.HClO C.H2SO4 D.CH3COOH E.H2CO3
③把CO2气体通入饱和碳酸钠溶液中,可以观察到的现象为________,原因为________(用离子方程式表示)。
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为____________。
(3)某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是_______。

A.加入适量BaCl2(固体)可以使溶液由d点变到c点
B.通过加水稀释可以使溶液由b点变到a点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp等于c点对应的Ksp
下表列出了某冷轧厂排放的废水中各成分的含量及国家环保标准值的有关数据:
| 冷轧含锌 废水水质 | 经处理后的水国 家环保标准值 |
Zn2+浓度/(mg·L-1) | ≤800 | ≤3.9 |
pH | 1~5 | 6~9 |
SO42-浓度/(mg·L-1) | ≤23 000 | ≤150 |
经某一工艺处理后的废水pH=8,常温下,该废水中Zn2+的浓度为 mg·
L-1(常温下,Ksp[Zn(OH)2]=1.2×10-17), (填“符合”或“不符合”)国家环保标准。