��Ŀ����
����Ŀ���Ը���������(��Ҫ�ɷ�ΪAl2O3��Fe2O3��SiO2������FeS2�ͽ���������)Ϊԭ�ϣ����������������Fe3O4�IJ��ֹ����������£�
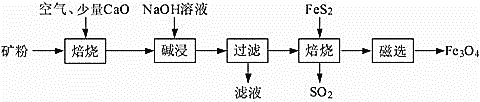
(1)���չ��̾������SO2����NaOH��Һ���չ���SO2�����ӷ���ʽΪ___________�������������������Ҳ�dz�ȥSO2�ij����������Ƚ���SO2�ķ�������ˮ�����ñ���ʯ�ҽ����ա����¶�������Һ��c(Ca2+)һֱ����Ϊ0.50 mol��L-1����֪KSP(CaSO3)=1.4��10-7�������պ���Һ��![]() ��Ũ��______________________��
��Ũ��______________________��
(2)����1%CaO�Ͳ�����CaO�Ŀ�۱��գ�����ȥ�������¶ȱ仯������ͼ��ʾ��
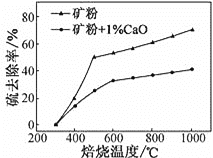
��֪���������������εķֽ��¶ȶ�����600�棻��ȥ����=(1![]() )��100%
)��100%
�ٲ�����CaO�Ŀ���ڵ���500 �決��ʱ��ȥ������Ԫ����Ҫ��Դ��____________��
��700�決��ʱ������1%CaO�Ŀ����ȥ���ʱȲ�����CaO�Ŀ����ȥ���ʵͣ�����Ҫԭ����________________��
(3)���ˡ��õ�����Һ��ͨ�����CO2���������ӷ�Ӧ�����ӷ���ʽ_________
(4) �����ˡ��õ��������к�������Fe2O3��Fe2O3��FeS2��Ϻ���ȱ�������±�������Fe3O4��SO2����������ȫ��Ӧ���ĵ�n(FeS2)��n(Fe2O3)=__________________��
���𰸡�SO2+OH=HSO3 2.8��10-7mo1/L FeS2 ��Ԫ��ת��ΪCaSO4�����ڿ���� AlO2����CO2��2H2O�� Al(OH)3����HCO3�� 1��16
��������
(1)��NaOH��Һ���չ�����SO2������HSO3-������Ksp= c(Ca2+) c(![]() )����c(
)����c(![]() )��
)��
(2) �ٲ�����CaO�Ŀ����SԪ�ص���Դ��FeS2�ͽ��������Σ����������εķֽ��¶Ƚϸߣ�
��700�決��ʱ������1%CaO�Ŀ����ȥ���ʵͣ�����CaO����ת��ΪCaSO4���γɵ������ηֽ��¶Ƚϸߣ�
(3)����ǰʹ��NaOH��Һ���м����Al2O3ת��ΪNaAlO2�������ˡ��õ�����Һ����Ҫ����AlO2-�����ˡ��õ�����Һ��ͨ�����CO2�����Խ�AlO2-ת��ΪAl(OH)3��
(4) �����ˡ��õ��������к�������Fe2O3��Fe2O3��FeS2��Ϻ���ȱ�������±�������Fe3O4��SO2�����ݵ�ʧ�����غ���м��㡣
(1) ��NaOH��Һ���չ�����SO2������HSO3-����Ӧ�����ӷ���ʽΪ��SO2+OH=HSO3��Ksp= c(Ca2+) c(![]() )�ɵ�c(
)�ɵ�c(![]() )=
)=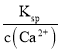 =
=![]() =2.8��10-7mol/L��
=2.8��10-7mol/L��
(2) �ٲ�����CaO�Ŀ����SԪ�ص���Դ��FeS2�ͽ��������Σ����������εķֽ��¶Ƚϸߣ����Կ����жϱ��չ�����SԪ�ص���Ҫ��Դ��FeS2��
��700�決��ʱ������1%CaO�Ŀ����ȥ���ʵͣ�����CaO����ת��ΪCaSO4���γɵ������ηֽ��¶Ƚϸߣ����Իᵼ��S��ȥ���ʽ��ͣ�
(3)����ǰʹ��NaOH��Һ���м����Al2O3ת��ΪNaAlO2�������ˡ��õ�����Һ����Ҫ����AlO2-�����ˡ��õ�����Һ��ͨ�����CO2�����Խ�AlO2-ת��ΪAl(OH)3�����ӷ���ʽΪAlO2����CO2��2H2O�� Al(OH)3����HCO3����
(4) �����ˡ��õ��������к�������Fe2O3��Fe2O3��FeS2��Ϻ���ȱ�������±�������Fe3O4��SO2������xmol Fe2O3��ymol FeS2�μӷ�Ӧ�����ݵ�ʧ�����غ�ɵ�2x��(3-![]() )=2y��5+y��(
)=2y��5+y��(![]() )�����
)�����![]() =
=![]() ������������ȫ��Ӧ���ĵ�n(FeS2)��n(Fe2O3)=1:16��
������������ȫ��Ӧ���ĵ�n(FeS2)��n(Fe2O3)=1:16��