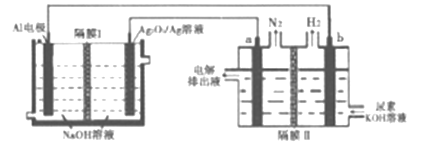
题目内容
【题目】A、B、C、D、E、F是短周期元素,周期表中A与B、B与C相邻;C与E同主族;A与C最外层电子数之比为2:3,B的最外层电子数比C的最外层电子数少1个; F元素的原子在周期表中半径最小;常见化合物D2C2与水反应生成C的单质,且溶液使酚酞溶液变红。
(1)E在周期表中的位置为____________________;B2F4的电子式_________________。
(2)B的最高价氧化物的水化物与其氢化物反应生成Z,则Z的名称为_______________,Z的化学键类型为____________________。
(3)可以比较C和E得电子能力强弱的是___________________(填写编号) 。
a.比较这两种元素最高正价的大小
b.二者形成的化合物中,D 元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
(4)两种均含C、D、E、F四种元素的化合物相互反应放出气体的反应离子方程式为_____________________________________。
【答案】 第三周期第ⅥA族 电子式: 硝酸铵 离子键、共价键 b.c HSO3- +H+ = H2O+SO2 ↑
硝酸铵 离子键、共价键 b.c HSO3- +H+ = H2O+SO2 ↑
【解析】本题元素周期表和元素周期律的应用,F元素的原子在周期表中半径最小,即F为X,常见的化合物D2C2与水反应生成C的单质,且溶液显碱性,则D2C2为Na2O2,C为O,D为Na,C和E同主族,则E为S,A与C最外层电子数之比为2:3,则A的最外层电子数为4,因为A与B相邻,B与C相邻,因此A为C,B为N,(1)E为S,位于第三周期VIA族;化学式为N2H4,其电子式为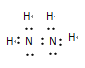 ;(2)N的最高价氧化物的水化物是HNO3、氢化物为NH3,两者反应生成NH4NO3,名称为硝酸铵;硝酸铵属于离子化合物,含有离子键和(极性)共价键;(3)a、比较非金属性的强弱或得电子能力,与元素的最高正价大小无关,故a错误;b、形成的化合物,得电子能力强的电子对偏向谁,化合价显负价,故选项b正确;c、得电子能力越强,非金属性越强,其氢化物的稳定性越强,因此通过两种元素的氢化物的稳定性,判断得电子能力,故c正确;(4)这两种化合物是NaHSO4和NaHSO3,因此反应的离子方程式为HSO3-+H+=SO2↑+H2O。
;(2)N的最高价氧化物的水化物是HNO3、氢化物为NH3,两者反应生成NH4NO3,名称为硝酸铵;硝酸铵属于离子化合物,含有离子键和(极性)共价键;(3)a、比较非金属性的强弱或得电子能力,与元素的最高正价大小无关,故a错误;b、形成的化合物,得电子能力强的电子对偏向谁,化合价显负价,故选项b正确;c、得电子能力越强,非金属性越强,其氢化物的稳定性越强,因此通过两种元素的氢化物的稳定性,判断得电子能力,故c正确;(4)这两种化合物是NaHSO4和NaHSO3,因此反应的离子方程式为HSO3-+H+=SO2↑+H2O。

 阅读快车系列答案
阅读快车系列答案【题目】如图所示,在元素周期表中处于A,B位置的某些元素性质相似,这称为“对角线规则”.下列有关4号元素铍的性质的推断正确的是( )
A | |
B |
A.铍能与冷水发生剧烈反应
B.氢氧化铍既能与强酸溶液反应,又能与强碱溶液反应
C.氢氧化铍的化学式为Be(OH)3
D.氧化铍只溶于强酸溶液,不溶于强碱溶液