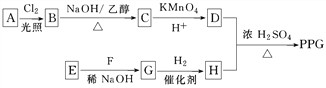
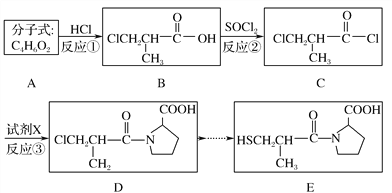
��Ŀ����
����Ŀ��������Ϊ12.64gKMnO4�������һ��ʱ����ռ���amol O2����Ӧ������Ĺ����м���������Ũ���ᣬ���ռ���bmolCl2����ʱMnԪ��ȫ����Mn2+����ʽ��������Һ�У���KMnO4 ��Ħ������Ϊ158g/mol ��
��1������ɲ���ƽ���л�ѧ����ʽ��
_K2Mn04+__HCl��������__KCl+__MnCl2+__Cl2��+___
�÷�Ӧ�еĻ�ԭ����_____�����÷�Ӧ��ת��NA������ʱ��������������ʵ���Ϊ_____mol���������Ļ�ԭ�������ʵ���Ϊ_____mol��
��2�������Ը��������Һ�ζ�FeSO4��Һд���÷�Ӧ�����ӷ���ʽ��_____��
��3����KMnO4�����������O2 amolֵ���ʱ����Ӧ������Ĺ����м���������Ũ���Ტ���ȣ�����Cl2�����ʵ���b=_____mol������ʱMnԪ��ȫ����Mn2+����ʽ��������Һ�У�
���𰸡� 1 8 2 1 2 4H2O HCl 0.5 1 �������10��5Fe2++MnO4��+8H+�T5Fe3++Mn2++4H2O 0.12
����������1��MnԪ�صĻ��ϼ۽���5��ClԪ�صĻ��ϼ�����1���ɵ����غ��ԭ���غ��֪����ӦΪ2KMnO4+16HCl=2KCl+2MnCl2+5Cl2��+8H2O���ʴ�Ϊ��2��16��2��2��5��8����������ԭ��Ӧ�еõ��Ӽ�̬���͵�����Ϊ����������Ӧ2KMnO4+16HCl=2KCl+2MnCl2+5Cl2��+8H2O�У�HClʧ���Ӽ�̬����Ϊ0�۵�����������HClΪ��ԭ������ԭ��ʧ�������ɵ�����Ϊ���������2KMnO4+16HCl=2KCl+2MnCl2+5Cl2��+8H2O�У���������Ϊ������HClʧȥ1mol����ʱ�������������������ʵ���Ϊ0.5mol���ʴ�Ϊ��HCl��0.5mol��
��2�������Ը��������Һ�ζ�FeSO4��Һд���÷�Ӧ�����ӷ���ʽ�� 5Fe2++MnO4��+8H+�T5Fe3++Mn2++4H2O����3��KMnO4���壨����Ϊ12.64g�����ʵ���Ϊ0.08mol������һ��ʱ�䣬������Ӧ��2KMnO4 ![]() K2MnO4+MnO2+O2�����õ��Ĺ���������غͶ������̵Ļ����õ�0.04molO2�����ݵ���ת���غ㣬���������У�MnԪ�ػ�õ��ӵ���OԪ�ء�ClԪ�ػ�õĵ��ӣ����У�0.08����7-2��=4a+2b��������b=0.2-2a��
K2MnO4+MnO2+O2�����õ��Ĺ���������غͶ������̵Ļ����õ�0.04molO2�����ݵ���ת���غ㣬���������У�MnԪ�ػ�õ��ӵ���OԪ�ء�ClԪ�ػ�õĵ��ӣ����У�0.08����7-2��=4a+2b��������b=0.2-2a��
�����������ȫ�ֽ���������ʱ������������࣬�����������٣���2KMnO4![]() K2MnO4+MnO2+O2������֪���������������ʵ���Ϊ0.08mol��1/2=0.04mol����a���ֵ=0.04�������������٣���b��Сֵ=0.2-0.04-0.04=0.12������Cl2�����ʵ���b=0.12mol.
K2MnO4+MnO2+O2������֪���������������ʵ���Ϊ0.08mol��1/2=0.04mol����a���ֵ=0.04�������������٣���b��Сֵ=0.2-0.04-0.04=0.12������Cl2�����ʵ���b=0.12mol.

 ���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д�
���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д� ����ѵ��ϵ�д�
����ѵ��ϵ�д� ��ĩ�����ϵ�д�
��ĩ�����ϵ�д�