题目内容
【题目】下列说法中正确的是
A. 标准状况下,22.4 L水中所含的分子数约为6.02×1023个
B. 1 mol Cl2中含有的原子数为NA
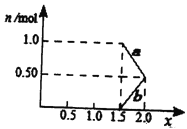
C. 标准状况下,a L氧气和氮气的混合物含有的分子数约为![]() ×6.02×1023个
×6.02×1023个
D. 从1 L0.5 mol·L-1NaCl溶液中取出100 mL,剩余溶液中NaCl物质的量浓度为0.45 mol·L-1
【答案】C
【解析】试题A、标准状况下,水不是气体,不能使用标况下的气体摩尔体积计算22.4L水的物质的量,故A错误;B、1 mol Cl2中含有的原子数为2NA,故B错误;C、标况下,aL氧气和氮气的物质的量为: ![]() mol,含有的分子数约为
mol,含有的分子数约为![]() mol×6.02×1023,故C正确;D、从1 L0.5 mol·L-1NaCl溶液中取出100 mL,剩余溶液中NaCl物质的量浓度仍为0.5 mol·L-1,故D错误;故选C。
mol×6.02×1023,故C正确;D、从1 L0.5 mol·L-1NaCl溶液中取出100 mL,剩余溶液中NaCl物质的量浓度仍为0.5 mol·L-1,故D错误;故选C。

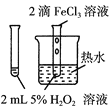
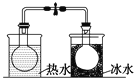
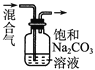
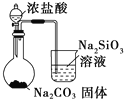
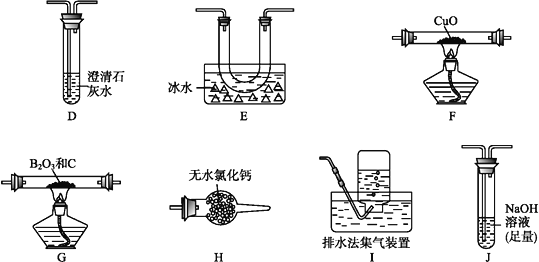
【题目】下列图中的实验方案,能达到实验目的的是
选项 | 实验方案 | 实验目的 |
A |
| 验证FeCl3对H2O2分解反应有催化作用 |
B |
将NO2球浸泡在冰水和热水中 | 探究温度对平衡2NO2 |
C |
| 除去CO2气体中混有的SO2 |
D |
| 比较HCl、H2CO3和H2SiO3的酸性强弱 |
A. A B. B C. C D. D
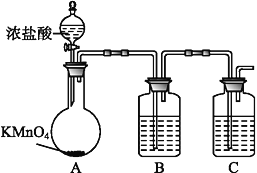
【题目】某校研究性学习小组的同学进行了以下化学实验:将金属钙置于空气中燃烧,然后向所得固体产物中加入一定量蒸馏水,此过程中反应放出大量的热,并且放出有臭味的气体。
(1)甲同学提出:运用类比学习的思想,Ca与Mg位于同一主族,化学性质具有一定的相似性。请写出Ca在空气中燃烧发生反应的化学方程式_______________________________。
(2)乙同学提出:Ca的性质比Na活泼,在空气中燃烧还应有CaO2生成,请写出燃烧后固体产物与水反应放出气体的化学方程式______________________________。丙同学提出用实验的方法探究放出臭味气体的成分:
(查阅资料)
1.CaO2遇水反应生成H2O2,H2O2可能会分解产生一定量的O3。
2.碘量法是最常用的臭氧测定方法,其原理为强氧化剂臭氧(O3)与碘化钾(KI)水溶液反应生成游离碘(I2),臭氧转化为氧气。反应式为O3+2KI+H2O===O2+I2+2KOH。
(提出假设)
假设1:该臭味气体只有NH3;
假设2:该臭味气体只有________;
假设3:该臭味气体含有________。
(设计方案 进行实验探究)
(3)该小组同学设计如下实验方案,并进行实验,验证上述假设。请完成相关的实验操作步骤、预期现象及结论(仪器自选)。
限选实验试剂:红色石蕊试纸、蓝色石蕊试纸、pH试纸、淀粉-KI溶液、蒸馏水。
实验操作 | 预期现象与结论 |
取少量反应后固体于试管中,_____________ | ______________________________________ |